索凡替尼在美上市被拒,黄医药美股开盘暴跌超过13%
今天(5月2日),黄医药披露内幕消息称,美国FDA已就索凡替尼治疗胰腺和非胰腺神经内分泌瘤的新药上市申请发出完整回复函。FDA认为目前基于两项成功的中国 III 期研究和美国桥接研究的数据包不足以支持药药品批准还不够。
完整的回复函表明,国际多中心临床试验需要者的国际多中心临床试验(MRCT)支持美国获批。
受此消息影响,和黄医药(HCM.O)美股开盘暴跌超过13%。
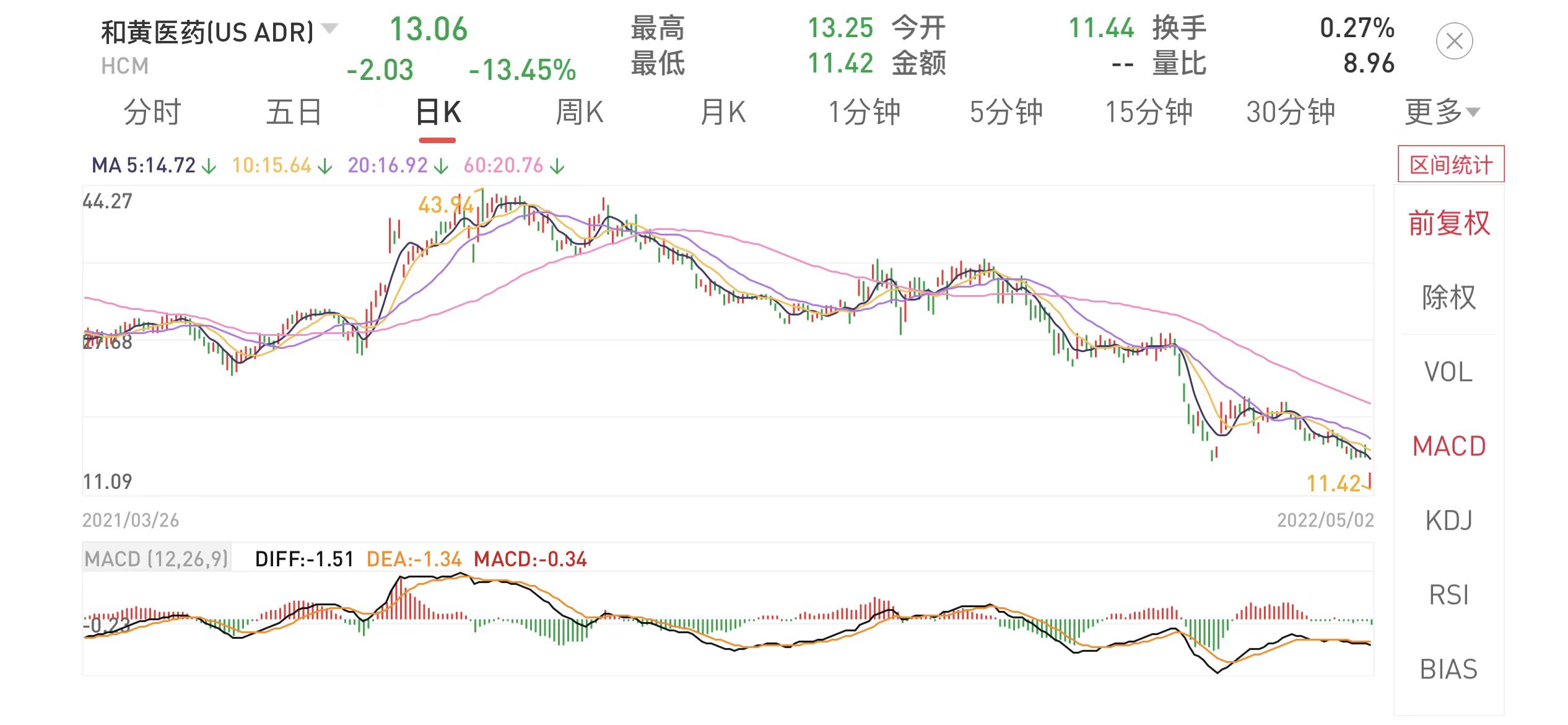
截至发布,和黄医药自2021年7月底最高点43.94美元/股,已下跌70%以上。
索凡替尼:
索凡替尼是一种具有抗血管生成和免疫调节双重活性的口服抑制剂。其安全性和疗效已在中国晚期胰腺和非胰腺神经内分泌瘤患者中随机双盲发展III期研究(即SANET-ep和SANET-p研究)已被证明。一项由和黄医药申办并在美国进行的桥接研究的结果也显示了两项SANET研究人群中类似的安全性和疗效。2021年6 月和2020年12月,索凡替尼被批准治疗胰腺神经内分泌瘤和非胰腺神经内分泌瘤。
索凡替尼于2020年4月获得美国FDA获得治疗胰腺和非胰腺神经内分泌瘤的快速通道资格,并于2019年11月获得治疗胰腺神经内分泌瘤的孤儿药物资格。2020年5月,和黄医药在新药上市申请前会议FDA 达成协议,索凡替尼用于治疗胰腺和非胰腺神经内分泌瘤患者取得积极成果的中国 III 期研究,结合索凡替尼美国桥接研究的现有数据,可以构成支持在美国提交新药上市申请的依据。FDA2021年6月30日,索凡替尼受理了新药上市申请。
此外,2021年7月,和黄医药宣布,欧洲药品管理局表示,(EMA)确认并接受索凡替尼(Surufatinib)治疗胰腺外神经内分泌瘤(NET)申请上市许可证(MAA)。EMA已确认提交材料的完整性,并准备启动正式的评审程序。
在美国上市被拒绝后,索凡替尼后续能否被拒绝EMA批准上市,新浪医药将继续关注。
本土创新药企出海路
今年国产创新药出海屡遭不顺。
今天,君实生物也宣布,其PD-1特瑞普利单抗在美国上市正式推迟。君实生物表示,计划和计划与计划,以及计划与计划。FDA直接会面,预计2022年仲夏前重新提交联合吉西他滨╱顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单一用于复发或转移性鼻咽癌的生物制品许可证申请(BLA)。
与索凡替尼类似,今年年初,信达生物的信迪利单抗也被称为FDA建议补充头对头标准疗法(即拒绝批准)K药物), 以总生存期(OS)非劣效是主要终点,全球多中心III临床期过后,再给予批准。
此外,值得注意的是,2022年3月8日,美国证监会(SEC)包括百济神州、再鼎医药、和黄医药三家医药企业被列入《外国公司问责法》(Holding Foreign Companies Accountable Act,简称HFCAA)暂定清单。
2022年3月29日,SEC官网显示,百济神州、再鼎医药、和黄医药未能从《外国公司问责法》和暂定名单中删除,正式列入确认订单。
根据《外国公司问责法》的要求,被列入名单的公司连续三年不能满足美国公共公司会计监督委员会的要求PCAOB)对会计师事务所的检查要求,其证券禁止在美交易。在第一次交易禁令后,如果名单仍被确定,将继续执行至少五年的交易禁令。也就是说,列入名单的企业将有被强制退市的风险。
