CTLA-4:开创免疫疗法先河
CTLA-4(细胞毒性T淋巴细胞相关蛋白4)CD152(分化簇 152)是一种蛋白质受体,是免疫球蛋白超级家族的成员,它是活化的T将抑制信号传递给细胞T细胞。CTLA-4可作为免疫检查点,降低免疫应答,CD28共同享有B7分子配体,而CTLA-4与B7分子结合后诱导T细胞无反应,参与免疫反应的负调节。
CTLA-4抑制剂是世界上第一种获批上市的免疫检查点抑制剂,开创了免疫治疗的先例。CTLA-4抑制剂已成为免疫联合治疗方案的关键环节,也是流行双抗产品的重要目标。
CTLA-4单抗研发现状
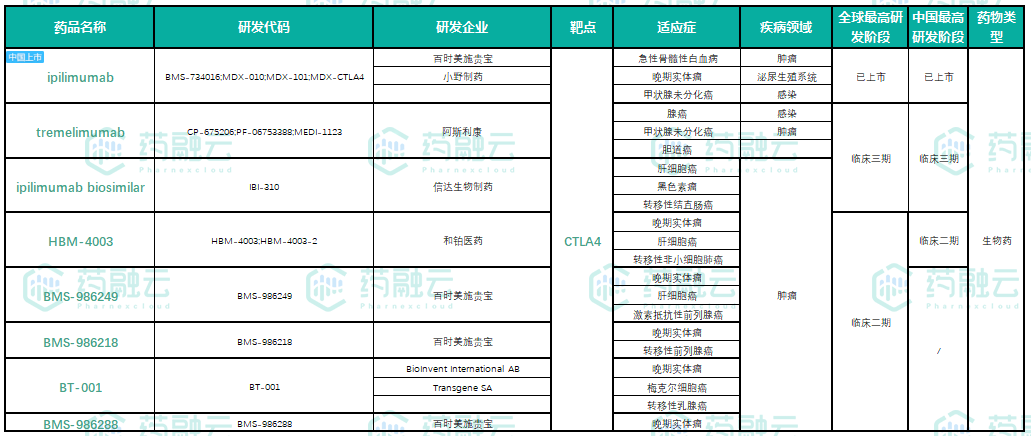
目前,全球范围内已获批准。CTLA-4单抗只有百时美施贵宝Yervoy(ipilimumab),2021年,该药也被批准在中国上市。其的都在中国。CTLA-4阿斯利康在单抗领域的研发进展迅速tremelimumab和信达生物IBI-310,均处于临床三期试验阶段。此外,还有百时美施贵宝的三款。CTLA-4单抗正处于临床二期阶段。中国制药公司研发进展迅速的是铂生物,目前是一种单抗。CTLA-4单抗也在进行临床二期试验。
CTLA-4单抗全球研发药物(临床2期及以上)
数据来源:药融云全球药物研发数据库
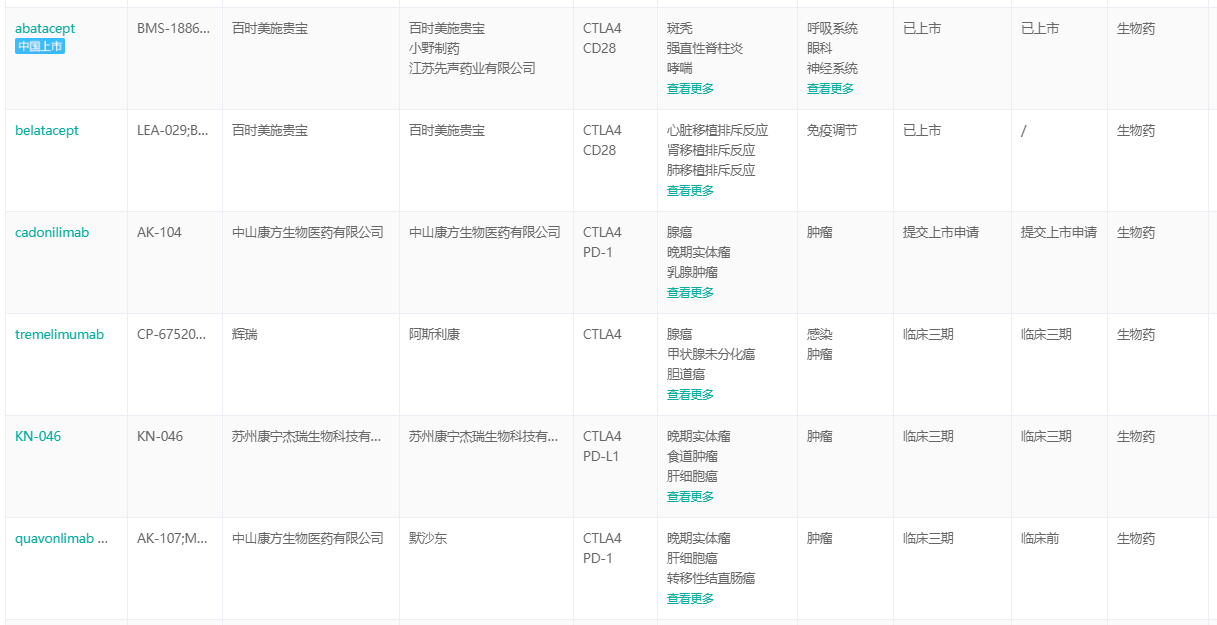
另外还有两个跟CTLA-4联合使用的药物也上市了,百时美施贵宝的两种药物CD28CTLA-4双抗——abatacept、belatacept。
随着PD-1为了获得差异化的竞争优势,行业内卷不断加剧,PD-1联合用药已成为大多数制药企业的破局方向。中国康方生物学。PD-1、CTLA-4双抗产品已于去年9年申请上市,有望成为国内首个上市产品PD-1 双特异性抗体;康宁杰瑞PD-1、CTLA-4双抗产品刚刚完成三期临床试验。
CTLA-4全球联合研发药物(部分)
截图来源:药融云全球药物研发数据库
阿斯利康CTLA-4单抗终获FDA优先审查
周一,阿斯利康宣布了它CTLA-4单抗tremelimumab与PD-L1单抗Imfinzi不能接受手术治疗的肝癌患者的联合治疗被申请FDA纳入优先审查。CTLA-4表达在活化中T淋巴细胞表面。通过结合。CTLA-4并阻断B7-1和B7-2与CTLA4的结合,tremelimumab介导T降低细胞活化。随后,,,B7-1或B7-2与另一T细胞表面受体蛋白CD28相互作用,诱导b7-CD28介导的T细胞活化。Tremelimumab这种机制被认为能刺激患者的免疫系统攻击肿瘤。根据药融云数据库,目前该机制已被认为是刺激患者的免疫系统。CTLA-4许多单抗适应症都处于临床三阶段,包括IV黑色素瘤、转移性膀胱癌、转移性非小细胞肺癌、小细胞肺癌、肾细胞癌、肝细胞癌等。
CTLA-4单抗tremelimumab基本信息
截图来源:药融云全球药物研发数据库
tremelimumab:CTLA-4单抗多年的研发之路
Tremelimumab命运可以说是曲折的,经过18年的发展,在辉瑞和阿斯利康之间,尝试了许多不同癌症的适应症发展方向。辉瑞将于2004年首次亮相tremelimumab投入临床试验,I期和II临床研究表明,它能诱导转移性黑色素瘤患者产生持久的肿瘤反应。但在这种情况下,它可以诱导转移性黑色素瘤患者产生持久的肿瘤反应。III在期间试验中,中期数据显示tremelimumab疗法不优于标准化疗。因此,辉瑞公司于2008年停止了治疗。tremelimumab治疗晚期黑色素瘤的临床试验后不久就放弃了tremelimumab。
当时针对CTLA-4研究项目中抑制剂有限,tremelimumab并引起多少水花。直到百时美施贵宝的研究证明阻断了CTLA-4可显著延长部分黑色素瘤患者的生命,并推出自己的生命CTLA-4单抗Yervoy(ipilimumab)。Yervoy于2013年获得FDA获得批准,而tremelimumab还远没有看到曙光。
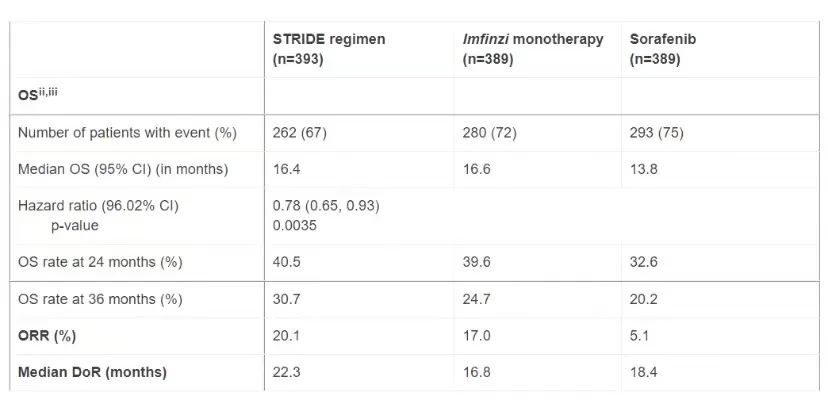
2011年,阿斯利康获得了辉瑞公司tremelimumab授权,希望进入免疫肿瘤学领域,但仍处于起步阶段,但tremelimumab在包括肺癌、尿路上皮癌和头颈癌在内的试验中不断失败,直到与肺癌、尿路上皮癌和头颈癌相结合。PD-L1单抗Imfinzi肝癌患者在不能接受手术的联合治疗中表现出积极的疗效。阿斯利康描述了阿斯利康。Imfinzi/tremelimumab组合在整体生存中取得了前所未有的成果。这是一个名为前所未有的结果。HIMALAYA的III1324名无法切除的肝细胞癌患者被随机分为三组STRIDE方案-每四周接受一次Tremelimumab和Imfinzi初始剂量;另一组单独服用Imfinzi;第三组接受 Nexavar (sorafenib)标准护理sorafenib相比,CTLA4/PD-L1抗体组合不仅将死亡风险降低了22%,研究人员还报告说,该组近31%的患者在三年登记时仍然活着,只有sorafenib组只有20%。
(HIMALAYA数据 图源:阿斯利康)
尽管Tremelimumab目前只在有限的适应症中表现出疗效,但如果获得批准,Tremelimumab将成为市场上的第二个CTLA-4单抗,成为百时美施贵宝的单抗,Yervoy竞争对手。此外,据悉,阿斯利康也在加速推进Tremelimumab与Imfinzi转移性肺癌的联合治疗已获得批准,尽管目前尚不清楚组合治疗和Imfinzi单药有多少好处?
参考来源:
[1]
[2]药融云数据库 https://www.pharnexcloud.com/?zmt-xlyy
[3] S.J. Enna,David B. Bylund,xPharm: The Comprehensive Pharmacology Reference,
Elsevier,2009,Pages 1-4,https://doi.org/10.1016/B978-008055232-3.64486-1.
[4] Fumito Ito,Marc S. Ernstoff,Immune Checkpoint Inhibitors in Cancer,Elsevier,2019,Pages 77-101,,https://doi.org/10.1016/B978-0-323-54948-6.00004-4.
[5] Margaret K. Callahan,Michael A. Postow,Jedd D. Wolchok,Chapter 19 - Antibodies to Stimulate Host Immunity: Lessons from Ipilimumab,Cancer Immunotherapy (Second Edition),https://doi.org/10.1016/B978-0-12-394296-8.00019-1.