亚盛医药/信达生物奥雷巴替尼上市3个月
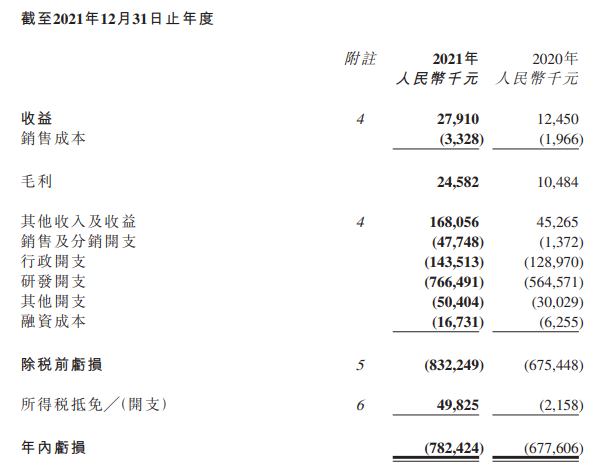
32月21日,亚盛医药公布了截至12月31日的2021年期内,亚盛收入2791万元,同比增长123.2%主要来自第一个商业产品的销售、商业许可费收入和专利知识产权许可费收入。
亚盛医药2021年度财务数据
值得一提的是,2021年11月亚盛核心品种,第三代BCR-ABL抑制剂奥雷巴替尼(商品名称:耐立克?)正式获批在中国上市销售。
奥雷巴替尼是中国第一个也是目前唯一的三代替尼Bcr-Abl抑制剂,亚盛和信达于2021年7月达成合作,共同开发和商业化。截至2022年2月底,奥雷巴替尼累计发票金额为5041万元(未经审计含增值税)。
20212000年,亚盛医药为人民币7.67亿元,较去年同期增长35.8%。
亚盛医药正在研究管道
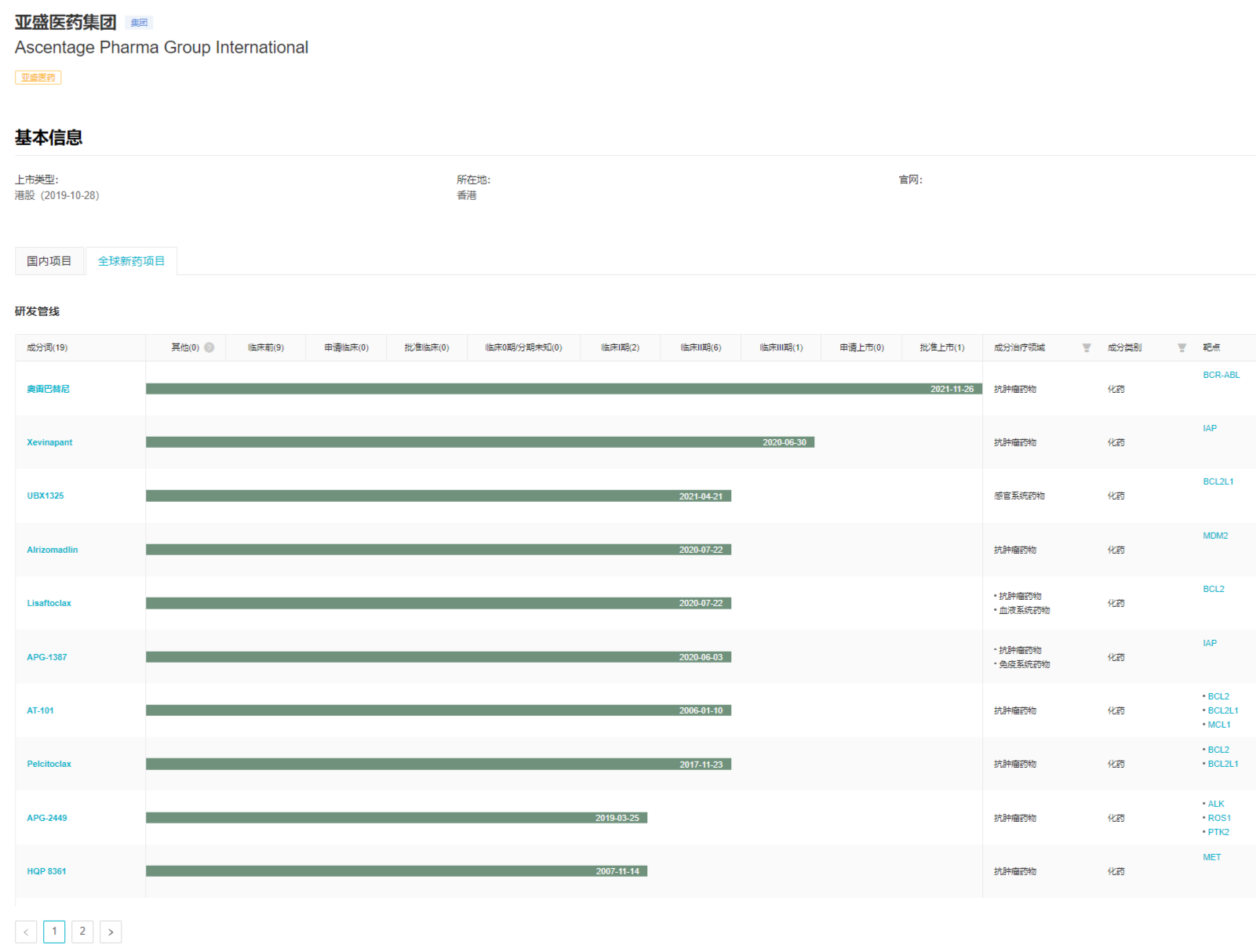
来自:Insight数据库企业分析模块(http://db.dxy.cn/v5/home/)
公司正在推进研发产品的全球临床开发,目前在中国、美国、澳大利亚和欧洲同时开展了50多个项目I/II临床试验。同时,公司坚持全球知识产权布局。截至2021年12月31日,亚盛医药在全球拥有授权专利178项,专利600项,其中海外授权专利约135项。
值得一提的是,在报告期内,奥雷巴替尼在报告期内获得了第一个欧盟孤儿药物资格;作为具有欧盟孤儿药物资格的人;「first-in-class」潜力,中国第一个进入临床阶段MDM2-p53抑制剂APG-115,在报告期内再次获得美国FDA获得孤儿药资格认证,并首次获得孤儿药资格认证FDA快速通道资格认定。截至目前,亚盛医药已获得2项,亚盛医药已获得2项。FDA快速通道资格认证15项FDA以及欧盟孤儿药资格证书。
报告期内,亚盛医药核心品种耐立克?2021年上半年,完全批准注册临床研究已完成患者入组,用于评估治疗一代/二代TKI耐药性和/或不耐受性CML病人的有效性和安全性。耐立克克?2021年3月,中国国家药品监督管理局获得管理局授予(NMPA)新药评价中心(CDE)纳入「突破性治疗品种」。
作为中国第一个进入临床阶段的国内研发人员Bcl-2选择性抑制剂,APG-2575复发/难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(R/RCLL/SLL)的关键注册II2021年底,中国国家药品监督管理局获得了临床研究(NMPA)新药评价中心(CDE)批准并于2022年3月完成首例患者给药,是世界上第二个进入临床注册阶段的患者Bcl-2选择性抑制剂。此外,在报告期内,APG-2575晚期单药或与其他抗癌药物联合治疗ER 乳腺癌或其他实体瘤的临床研究申请(IND)获FDA许可意味着实体瘤领域的正式开始扩大。到目前为止,APG-257518项临床研究涉及多个血液肿瘤和实体瘤适应症。
注:原文已被删除
