中国抗癌药物开发成功率分析
2月24日,中山大学肿瘤防治中心张力教授、北京大学肿瘤医院沈林教授团队、国家药品评价中心杨志敏部长联合签约顶级期刊Cancer Cell(影响因素:31.743)发表一篇题为的文章《Time to raise the bar: Transition rate of phase 1 programs onanticancer drugs》文章主要针对近10年来中国抗癌药物的文章I分析最终批准的开发成功率,分析中美数据差异和中国数据变化趋势。

本文将与您分享,供参考。以下是论文翻译内容:
抗癌药物的研发是一项高风险的工作。2003-2011年间进入I以肿瘤为主要适应症的研究药物(n=489),最终批准的比例只有13.2%。近十年来,抗癌药物的发展重点从细胞毒性药物转移到分子靶向药物 (MTA) 和免疫治疗药物,抗癌药物的发展模式和监管过程也发生了重大变化。
20112000年,默沙东启动了帕博利珠单抗首次人体临床研究(FIH),代号KEYNOTE-001,确定帕博利珠单抗的耐受性和推荐剂量。三年后,这种单抗的耐受性和推荐剂量。FIH研究最终成为包含多个扩展队列的临床试验,也使帕博利珠单抗在创纪录时间内获得批准(FDA,20142000年)。子的鼓励下,FIH肿瘤学研究越来越不受其传统结构和目标的限制。创新设计被纳入其中。FIH肿瘤学临床试验旨在最大限度地降低产品风险,加快药物开发。
自2016年深化药品监管体制改革以来,中国已成为研究药物临床试验最多的国家之一。考察靶向治疗和免疫治疗时代I期抗癌药物开发成功率分析FIH我们评估了研究设计对药物开发结果的影响2012-2020年间在中国大陆进行I研究性抗癌药物(不包括仿制药和生物类似药物)也包括在中国作为临床实践I期研究但属于国外FIH研究药物。每种药物的开发路径和发展路径。FIH对研究特征进行评价Ⅰ抗癌药物的转化率和创新研究设计的影响。
为了评估I期抗癌药物的转化率,Hay2012年1月1日至2020年12月31日,FIH研究的药物(n=413)的Ⅰ计算期成功率、批准率和暂停/终止率63.9% (n=264)是靶向药物,25.2% (n=104)是免疫肿瘤学(I-O)药物,一般的I期成功率为83%,高于报告I期成功率历史数据(68.9%),也高于2011-2020年全球成功率(48.8%)。中国的临床实践I期高成功率可能归因于失败的临床I项目报告不足或延迟在中国制药公司尤为常见。
尽管I临床研究的成功率很高,但已进入I抗癌药物的最终监管批准率很低。FIH只研究药物5.8最终于拿到了NMPA批准。这一批准率与美国和美国的批准率。FDA最近的数据相当。BIO QLS Advisors报告FDA在2011-2020年间进入I期后抗癌药物抗癌药物的可能性是5.3%。
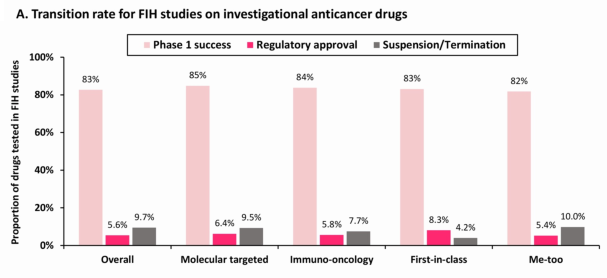
但这两个数字几乎是2003-2011年Ⅰ抗癌药物最终批准历史数据(13.2%)的三分之一。这一变化可能部分归因于肿瘤学领域研究性新药数量的显著增加,尤其是在中国。
2020年NMPA报告显示,中国抗癌药物在研究新药物中的比例最高(化学制剂)42.1%,生物制剂47.3%),其中I药物最多。尽管如此,近十年来,近十年来,药物最多。I最终批准率的下降表明,在靶向治疗和免疫治疗时代,抗癌药物的研发风险和复杂性增加,疗效和安全性之间的关系并不像细胞毒性药物那么简单。此外,与过去十年的抗癌药物研发相比,目前的抗癌药物研发实际上是肿瘤学领域的高水果,自然会伴随着更多的挑战和更低的回报。
靶向药物和IO药物在转化率上没有显著差异。虽然没有统计意义,但是FIC药物相较me-too药物在I期研究成功率(83% )vs 82%,p=0.713)、批准率(8.3% vs 5.4%,p=0.635)以及暂停/终止率(4.2% vs 10%,p=0.591)它似乎表现得更好。Me-too药物相对较低的转化率可能是由多种因素引起的。首先,与相比,与相比,药物的转化率相对较低。FIC药物(n=24),大量me-too药物(n=389)的FIH研究可能会在一定程度上稀释整体批准率。其次,随着时间的推移,随着时间的推移。FIC药品批准,me-too药物审查可能采用更严格的标准。
然而,越来越多me-too药物进入FIH研究只有较低的批准率和较高的暂停率,这不得不让我们启动这些药物FIH对研究标准有疑问。暂停和/或终止。FIH的me-too在项目中,疗效(31%)和商业考虑(14%)是最常见的原因。FIH该计划被暂停,因为这些药物在入组患者中没有反应(例如,CTR20171659、CTR20181130),未来提供明确的数据来支持未来的研究(例如,CTR20180885),或者被认为不太可能展示比其他批准的药物好(例如,CTR20130972)。这些徒劳的Ⅰ期间研究允许患者接受不必要的无效治疗,并消耗其他潜在项目的宝贵资源。通过更充分的临床前研究,在临床试验前对市场前景和监管政策进行更全面的评估,并允许启动FIH在研究之前进行更严格的审查是可以避免或至少改善的。
中国抗癌药物FIH研究中,34.6%采用全球多中心设置,34.1%增加了扩展队列,11.9% 采用无缝试验设计,53%采用生物标志物或组织学富集的患者选择策略,17.2%扩大了包括疗效评估在内的主要终点。me-too与药物研究相比,FIC药物的FIH创新试验设计更有可能用于研究,包括全球多中心设置(p=0.012)、增加扩展队列 (p=0.003)、使用无缝试验设计 (p=0.001),扩大包括疗效评估在内的主要终点(p=0.001)。此外,在靶向药物和IO药物之间的研究和设计没有明显的差异。
一般来说,在FIH采用创新设计和更高的研究I期成功率与更高的批准率有关。特别是,增加扩展队列 (p=0.020)并将主要终点扩展到疗效评估 (p=0.021) 的 FIH 研究与较高的药物批准率有关。在暂停率和/或终止率方面,全球多中心设置 (p
