新总结:间充质干细胞治疗多种神经系统疾病潜力无限!
最近在国际期刊上发表,《ADVANCED SCIENCE》综述系统总结了间充质干细胞治疗神经系统疾病的潜力。近年来,间充质干细胞广泛应用于各种神经系统疾病,包括中风、脊髓损伤、多发性硬化、肌萎缩侧索硬化、阿尔茨海默病等,未来如何更准确地实现间充质干细胞向神经系统损伤部位的迁移?[1],将是这一领域的新突破口。

随着社会的老龄化,神经系统疾病正成为一个日益沉重的负担,迫切需要解决螺旋式上升的问题。由于中枢神经系统(CNS)再生能力有限,神经系统损伤通常是不可逆转的。因此,与其他疾病相比,神经系统疾病的治疗范围有限。
近年来,基于干细胞的再生医学正成为这类疾病的一种有吸引力的手段。其中,间充质干细胞(MSCs)其独特性使其成为最受欢迎的细胞来源之一。许多研究表明,[1],干细胞治疗神经系统疾病的机制是通过旁分泌发挥神经营养和免疫调节的作用,而不是以前认为的神经元替代作用。
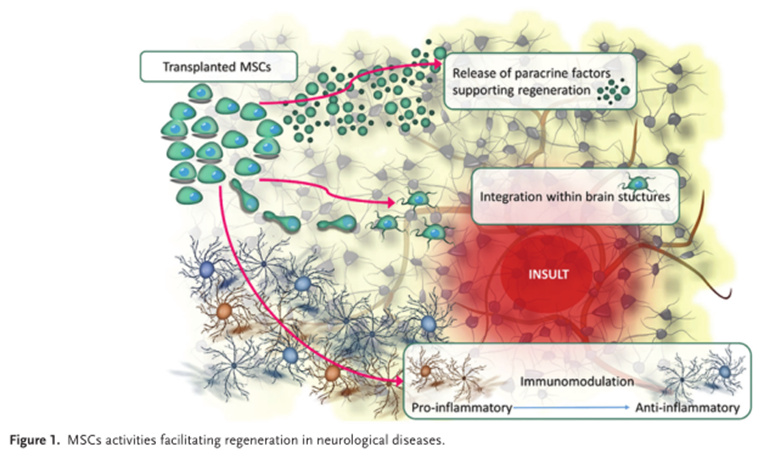
图片来自文献[1]
使用间充质干细胞(MSCs)细胞治疗是再生医学中发展最快的分支之一。MSCs骨髓、脂肪组织、脐带脐带、胎盘等各种来源轻松获得;免疫原性低,可用于同一异体;此外,MSCs 的多向分化、抗凋亡和抗炎能力也促进了他们在各种疾病治疗中的研究。
截至目前,已注册 125 项应用 MSCs 神经系统疾病的临床试验也包括各种中枢神经系统疾病。(下图为间充质干细胞治疗常见神经系统疾病的安全性和疗效)
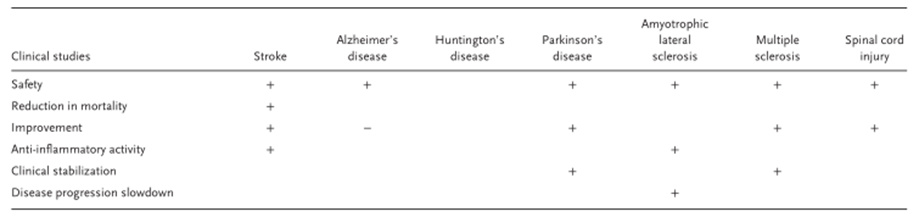
间充质干细胞和中风治疗
中风,又称中风,是由大脑血液循环中断引起的突然神经功能障碍。中风最可怕的是它会留下不同程度的后遗症,这可能只会导致轻微的活动减少,也可能导致严重的损害,给患者、家庭和社会带来沉重的负担。目前,中风的治疗方法包括使用溶栓药、动脉机械取栓等,但有些不足,如溶栓药治疗时间窗狭窄;动脉机械取栓后人会出现后遗症,限制了中风的有效治疗。因此,有必要寻找新的替代品或补充治疗方法。
一种可行的方法是基于干细胞的治疗。在不同类型的干细胞中,间充质干细胞(MSCs)这似乎为中风治疗提供了最好的前景,根据服从ClinicalTrials.gov网站和国际临床试验研究平台网站获取的数据,近一半的中风细胞治疗临床试验采用间充质干细胞。
动物研究表明[2-3],MSCs促进缺血损伤周围轴突密度的增加和重塑;MSCs通过增加血管密度增加血管密度和释放不同的生长因子来促进。MSCs还能保护受损的脑微血管免受缺血再灌注损伤;MSCs还具有免疫调节、抗炎、稳定血脑屏障等功能。
在一项1/2充质干细胞输注在慢性脑卒中患者治疗中的研究中[4]从单个供体分离的异基因骨髓间充质干细胞(BM-MSCs)36名静脉输注患者被证明是安全的;此外,在12个月的随访中,患者的功能状态评估明显改善。
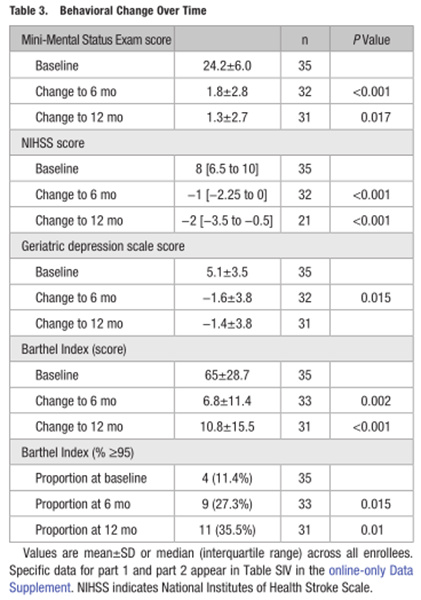
图片来自文献[4]
间充质干细胞和创伤性脑损伤治疗
创伤性脑损伤(TBI),顾名思义,它是由剧烈的外力冲击引起的脑损伤,导致神经功能损伤甚至死亡,通常发生在车祸、坠落等。到目前为止,还没有一种单一的治疗方法可以有效地降低脑损伤的死亡率或改善患者的功能恢复。因此,需要一种多靶点的治疗策略。许多临床前研究表明,在不同的脑损伤实验模型中使用间充质干细胞可以应对疾病中的各种病理变化。
MSCs移植后,通过刺激神经发生、血管生成、新神经元成熟及其神经保护,调节损伤大脑的炎症过程,促进神经组织修复。它可以改善认知,促进运动功能的恢复,并减少TBI脑组织受损[1]。
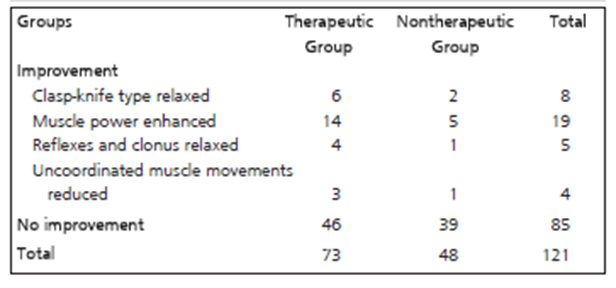
图片来自文献[6]
目前关于MSCs治疗TBI临床试验相对较少,一项研究97 名 TBI 亚急性期患者通过腰椎穿刺给明自体骨髓间充质干细胞安全有效,移植后约40% 患者表现出神经功能改善,其中24名患者中有11人持续植物状态(45%).8%)治疗后意识有所提高[6]。
间充质干细胞治疗其他神经系统疾病
间充质干细胞除了中风和创伤性脑损伤外,还在老年痴呆、帕金森病、肌萎缩侧索硬化等其他神经系统疾病中取得了进展,下图为间充质干细胞在神经系统疾病动物模型和临床试验中的疗效及目前临床试验数量的总结。不完全统计约140项。
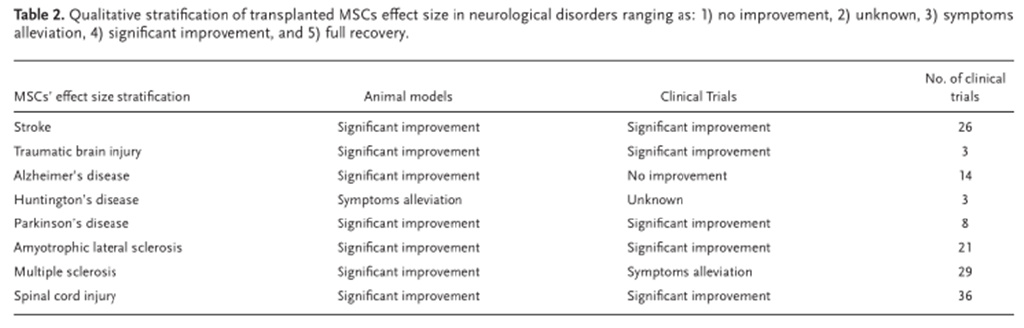
神经系统疾病治疗的下一个里程碑
间充质干细胞有望成为治疗神经系统疾病的下一个里程碑。为了加快这一进程,未来仍有许多挑战需要克服:
一方面,要进行更深入的基础研究,了解其治疗机制;进行更大规模的临床试验,以证明其安全性和有效性,
另一方面,由于神经系统疾病的复杂原因,为了进一步提高间充质干细胞的治疗潜力,需要使用各种技术,如间充质干细胞和其他药物;利用基因编辑技术改造间充质干细胞。
随着这些问题的逐步解决,充质干细胞有望为神经系统疾病的治疗带来新的局面!
参考文献:
[1] Andrzejewska A,Dabrowska S,Lukomska B,Janowski M. Mesenchymal Stem Cells for Neurological Disorders.Adv Sci (Weinh). 2021;8(7):2002944. Published 2021 Feb 24.
https://pubmed.ncbi.nlm.nih.gov/33854883/
[2] Horita Y,Honmou O,Harada K,Houkin K,Hamada H,Kocsis JD. Intravenous administration of glial cell line-derived neurotrophic factor gene-modified human mesenchymal stem cells protects against injury in a cerebral ischemia model in the adult rat.J Neurosci Res. 2006;84(7):1495-1504.
https://pubmed.ncbi.nlm.nih.gov/16998918/
[3] Dabrowska S,Andrzejewska A,Strzemecki D,Muraca M,Janowski M,Lukomska B. Human bone marrow mesenchymal stem cell-derived extracellular vesicles attenuate neuroinflammation evoked by focal brain injury in rats.J Neuroinflammation. 2019;16(1):216. Published 2019 Nov 13.
https://pubmed.ncbi.nlm.nih.gov/31722731/
[4] Levy ML,Crawford JR,Dib N,Verkh L,Tankovich N,Cramer SC. Phase I/II Study of Safety and Preliminary Efficacy of Intravenous Allogeneic Mesenchymal Stem Cells in Chronic Stroke.Stroke. 2019;50(10):2835-2841.
https://pubmed.ncbi.nlm.nih.gov/31495331/
[5] Shahror RA,Wu CC,Chiang YH,Chen KY. Tracking Superparamagnetic Iron Oxide-labeled Mesenchymal Stem Cells using MRI after Intranasal Delivery in a Traumatic Brain Injury Murine Model.J Vis Exp. 2019;(153):10.3791/60450. Published 2019 Nov 21.
https://pubmed.ncbi.nlm.nih.gov/31814625/
[6] Tian C,Wang X,Wang X,et al. Autologous bone marrow mesenchymal stem cell therapy in the subacute stage of traumatic brain injury by lumbar puncture.Exp Clin Transplant. 2013;11(2):176-181.
https://pubmed.ncbi.nlm.nih.gov/22891928/
