Day One Bio公司单臂临床试验取得积极成果
6月12日,Day One Bio.宣布,正在进行的关键II单臂临床试验(FIREFLY-1)获得积极的结果。这项研究的目的是评估公司每周一次tovorafenib(DAY101)单药治疗6个月至25岁复发性或进行性低级别胶质瘤患者。
儿童低级别胶质瘤(pLGG)脑瘤是儿童最常见的,占所有中枢神经系统肿瘤的30%-50%。根据肿瘤的大小和位置,pLGG它可以在许多方面影响儿童的健康,包括视力丧失和运动功能障碍。目前,没有针对这种疾病的治疗方法,也没有标准的治疗方法。尽管大多数pLGG患有癌症的儿童可能会面临越来越频繁的治疗,这可能会对他们的学习、认知和生活质量产生持久的影响。
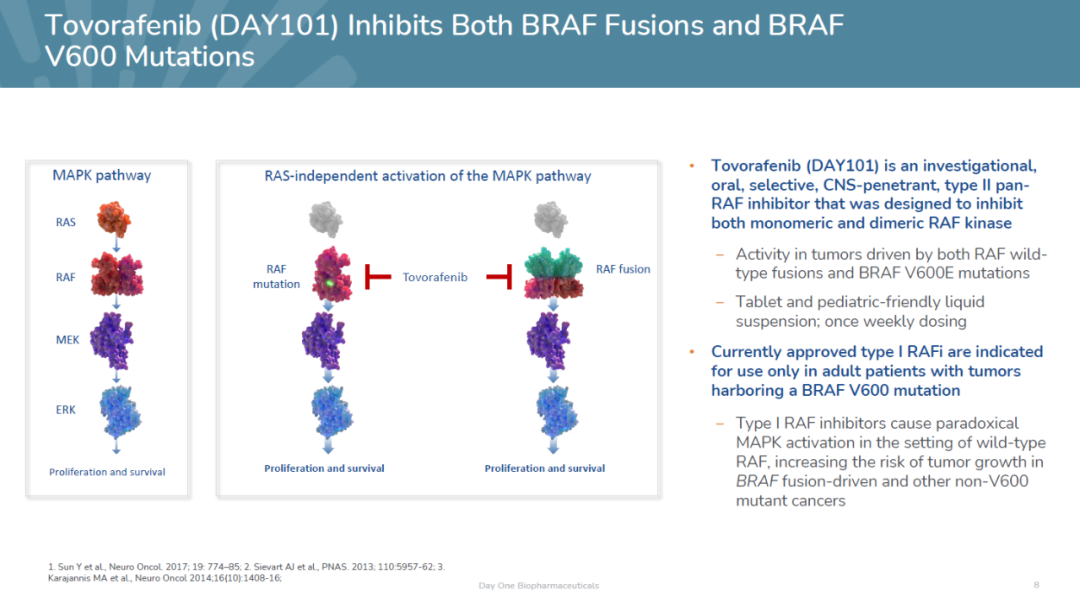
BRAF野生基因融合是低级儿童胶质瘤最常见的致癌基因组变化。这种类型的基因组变化也见于几种成人和儿童实体瘤。目前已获得批准BRAF只携带抑制剂BRAF V600突变肿瘤具有活性,脑肿瘤活性有限,不能携带BRAF融合患者。
Tovorafenib这是一种研究,口服,大脑渗透,高选择性II型泛RAF旨在靶向激酶抑制剂MAPK单聚和二聚在信号通道中RAF激酶。
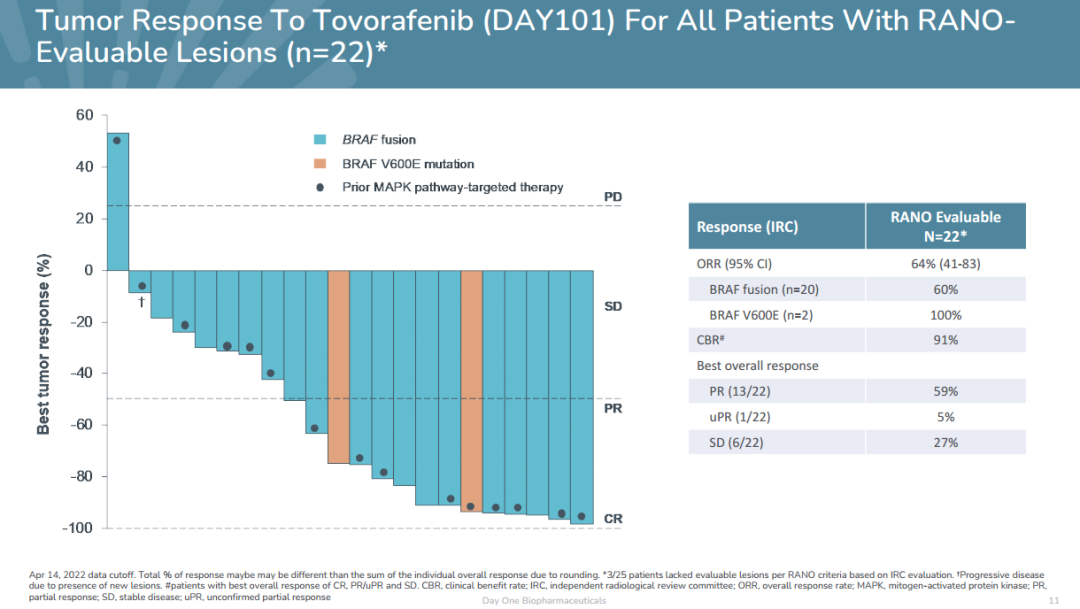
FIREFLY-1在研究中,参与实验的前25名患者的初始数据显示,22名患者的客观缓解率可以评估22名患者的疗效(ORR)临床获益率为64%,(CBR)达到91%,其中14例达到PR(13例PR和1例uPR),6例SD患者均观察到肿瘤缩小,范围为19%-43%;另外,在过去也接受过MAPK靶向治疗的BRAF融合和BRAF V600E观察缓解突变患者。
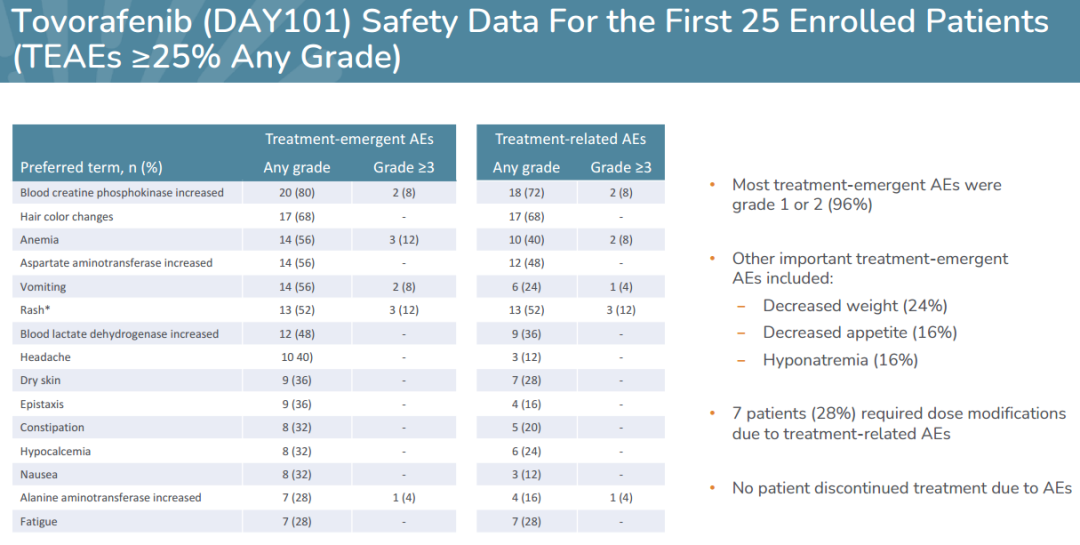
前25名患者的初步安全数据表明,tovorafenib单药治疗耐受性好。大多数不良事件(AE)1或2级;最常见的(≥25%任何级别)治疗相关AEs血肌酸磷酸激酶增加,皮疹和头发颜色发生变化。9名患者(36%)有3级或更高级别治疗相关AEs。
FIREFLY-1研究完整的关键临床结果预计将于2023Q1获得。Day One计划开展一项重点III临床研究,评估tovorafenib一线治疗pLGG预计2022年首例患者的疗效Q3入组。
除目前正在进行的原发性脑瘤治疗外FIREFLY-1研究外,Day One正在评估tovorafenib单药或联合治疗MAPK复发性或进展性实体瘤(FIRELIGHT-1)临床研究FDA已授予Tovorafenib治疗携带RAF基因改变的pLGG患者突破性治疗和罕见儿科疾病的认定。受这一积极消息的影响,Day One股价上涨126%。
原标题:泛RAF抑制剂 II期结果积极,Day One股价上涨126%

