Nature:偏离初衷,被医药企业使用?FDA或者修改立法加速批准路径
文丨紫苏
2021虽然外周和中枢神经系统药物咨询委员会在6月7日几乎全票反对,FDA仍在加速批准(accelerated approval,AA)渤健(Biogen)阿尔茨海默病新药Aducanumab当它被列入名单时,这个消息立即引起了巨大的争议。咨询委员会的三名成员辞职以抗议这一决定。随后,该批准成为美国联邦监管机构调查的对象,许多医院拒绝使用它Aducanumab,使其上市后的销售情况黯淡无光。同时,在该领域,FDA的AA一些专家也提出了质疑FDA将监管置于科学之上,让企业有漏洞可钻,还可能引发一系列不良连锁反应。
时至今日,距离Aducanumab事件已近一年。5月13日,《Nature》再次发文评论,这次争议事件之后,FDA加速批准是否会修改?(AA)路径?

对AA的质疑
今年5月,众议院能源和商业委员会负责监督药物安全和生物医学研究(The House Committee on Energy and Commerce)宣布,如果一家制药公司未能在合理的时间内完成后续研究,希望授予FDA通过更大的权力撤销权力AA上市药品。这个拟议的条款将被用作一个条款FDA再授权法案(funding reauthorization bill)预计将于今年9月通过。
Aducanumab事件并不是AA被攻击的唯一原因。AA自推出以来,已有279种治疗药物通过AA在过去10年中,近三分之二的药物通过这条路径上市(图1)。华盛顿特区非营利组织国家健康研究中心(National Center for Health Research)主席Diana Zuckerman说:路径变得越普遍,就意味着它的初衷已经改变。AA起初,它只是少数药物的一条特殊路径,但现在大多数抗肿瘤药物都是通过的AA或者其他加速审批路径。
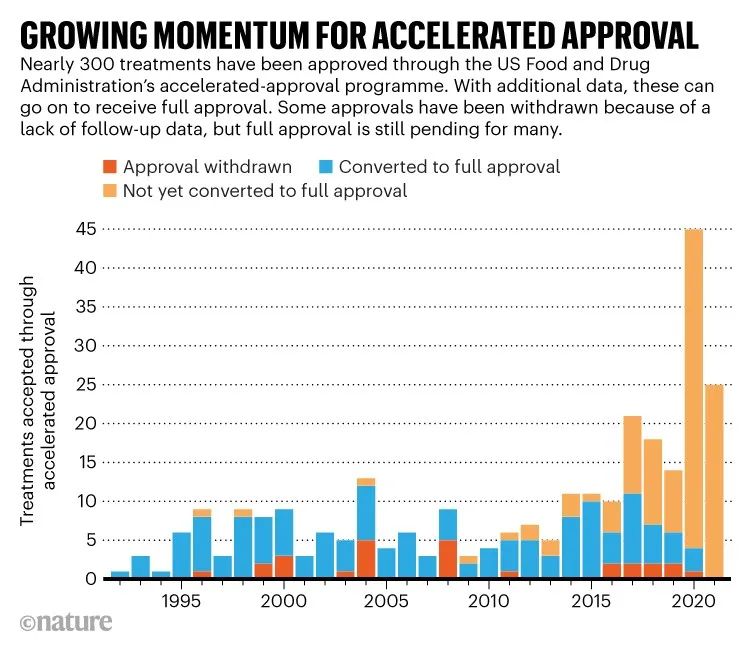
图1:通过AA上市药品情况(红色代表撤回批准,蓝色代表转换为完全批准,橙色代表未转换为完全批准)
此外,还需要进行后续研究AA部分路径,但制药企业在后续研究中进展非常缓慢。FDA他们被迫提供有限的数据。立法提案可能会被授予FDA尽管在众议院和参议院通过时,更大的权力仍能发生重大变化。
今年2月,FDA局长Robert Califf在被任命前几天,我答应了,会放手的AA改革作为FDA优先事项《Nature》采访的研究人员还表示,为了保护程序的完整性,迫切需要改革,立法提案是一个良好的开端。他们还建议加强机构监管和其他改革,以进一步防止制药公司滥用这种进入市场的方式。
华盛顿特区非营利组织病人买得起的药(Patients for Affordable drug)主席David Mitchell他说,制药公司并没有按照预期使用这条路径,反而有太多的企业试图在这里找到漏洞并加以利用。David Mitchell是FDA独立委员会的消费者代表审查抗肿瘤药物。
被速度绑架AA
FDA于1992年创立了AA路径,当时主要是为了应对HIV–AIDS危机是为了迅速将急需的药物推向市场。基于这条道路,需要批准的药物往往依赖于替代终点指标,而不是像这样OS由于替代终点可以比传统的临床试验终点得到更快的结果,因此具有临床意义。
流行病学家和全球健康专家在耶鲁大学康涅狄格州Gregg Gonsalves是说服FDA通过这条路径的小组成员之一。他说:我们之所以推进这条加速审批的道路,是因为有人死了,我就是我自己HIV我感到非常绝望,需要希望。
AA路径建立后,市场上免疫疗法和新型抗肿瘤疗法的数量显著增加。一些药物的临床效益数据有限,但患者每年需要花费数十万美元。Gonsalves制药企业已经使用了这条路径来加快审批速度。与通过标准路径上市所需的时间相比,通过AA平均而言,批准上市的抗肿瘤药物所需的时间可以缩短3年,并且可以使用单臂研究来代替终点。
马里兰州约翰霍普金斯大学彭博公共卫生学院(Johns Hopkins Bloomberg School of Public Health)内科和流行病学家Caleb Alexander说,AA一个重要的问题是,制药公司没有遵守他们的协议,在药品上市后及时研究,以澄清药品的临床效益。一些专家质疑制药公司进行确认性研究的时间是否过于宽松。2021年的一项分析发现,它是在1992年至2016年期间获得的AA在批准的药物中,13%的药物在5年内没有转化为完全批准——市场上的平均时间为9.5年。
公司联盟罕见病(Rare Disease Company Coalition)一位发言人说,药物上市后的临床试验可能需要很长时间,特别是对于进展缓慢的疾病,如神经退行性疾病。此外,制药公司也很难招募受试者,因为人们希望使用完全批准的药物,而不是冒着服用安慰剂的风险。Diana Zuckerman表示,FDA一种尚未转化为完全批准的药品,不能要求公司停止销售,通常是公司自愿撤市。Caleb Alexander一旦药品获得批准,FDA将失去他巨大的影响力。
例如,2011年FDA人们认为贝伐单抗治疗乳腺癌缺乏临床效益,并取消了加速批准,这遭到了公众的反对,因为乳腺癌患者希望保持批准。美国罕见疾病协会,康涅狄格州丹伯里非营利组织(National Organization For Rare Disorders)2021年的一份报告指出,对许多人来说,AA提供了宝贵的希望。但患有多发性骨髓瘤的人Mitchell然后想:给我希望的不是FDA,让我活着的不是希望,而是安全有效的药物。
FDA发言人Jeremy Kahn在一封电子邮件中,FDA致力于确保AA对于患有严重疾病但缺乏治疗选择的人来说,路径的完整性愿意接受一些不确定的新疗法。他补充说,绝大多数AA已经验证了药物的临床益处。
改变法律法规能解决问题吗?
FDA的AA其他国家的监管机构家的监管机构模仿,但欧盟和日本赋予其药品监管机构更多权力,使其能够要求公司在规定时间内提交确认性测试数据,否则将撤销其批准。
不清楚拟议中法律法规的变化是否正确FDA监管将发挥多大作用。这些条款将使FDA撤销批准比较容易,但也可以延长撤销批准的官僚程序。Diana Zuckerman表示,她更倾向于坚持早期提案,即一旦确认性试验逾期一年,自动撤销批准。
Caleb Alexander建议使用医疗保险作为杠杆。例如,美国医疗保险和医疗补贴服务中心位于巴尔的摩(CMS)可以决定哪些药物可以提供资金。今年年初,出于对Aducanumab担心疗效,CMS他说,这种药物每年将支付28800美元,只为参加临床试验的人群。
这个决定几乎是史无前例的,Caleb Alexander认为,CMS应该考虑减少其他尚未完全批准的人AA药品报销比例。他说,这样的举动可以点燃制药公司的大火,促使他们完成实验。当我们不知道一种药物的完全安全性和有效性时,纳税人为什么要为它的全部价格买单?
但Mitchell他担心,降低报销比例将使制药公司失去开发临床急需药物的动机。在诊断出骨髓瘤后,他觉得三种加速批准的药物使他活了下来。Aducanumab事件只是在AA这一伟大程序中的波动使人们更加关注一些药物的验证试验。改革并非如此简单。一旦一种药物进入市场,制药企业就不会急于找到停止生产的理由。
尽管如此,许多研究人员和药物安全支持者仍然渴望看到变化。Diana Zuckerman他说:我们开始试图纠正一个钟摆,它偏离了一个方向,看看现在,我们在这个方向上走了多远。
参考文献:
Kozlov M. Will the FDA change how it vets drugs following the Alzheimer's debacle? [published online ahead of print,2022 May 13]. Nature. 2022;10.1038/d41586-022-01316-8. doi:10.1038/d41586-022-01316-8

