历时近四年 三代EGFR抑制剂艾维替尼进入行政审批
5月6日,据Insight数据库监控,艾森医药马来酸艾维替尼胶囊(Abivertinib)上市申请已进入审批阶段,预计近期将获得审批结论。
艾维替尼是国内第一个申请上市的三代人。EGFR-TKI,2018年6月提交上市申请,但其审查过程浪费了近4年,引起了业界的讨论。在补充信息期间,韩森制药阿美替尼和艾力斯伏美替尼相继超车。
然而,在艾维替尼前景不明的时候,美股上市公司Sorrento首先引入药品的海外权益,然后直接引入潜在总额4.88 以1亿美元收购了艾森医药。在海外,艾维替尼正在积极推进多种适应症的临床试验。
曾经的「国产首款」,三代 白热化EGFR-TKI 竞争
艾维替尼是艾森医药自主研发的靶向EGFR敏感突变(19del、21L858R)和 T790M 三代突变EGFR-TKI,拥有全球化合物专利(PCT 国际专利公开号:WO2014/025486A1),主要用于治疗 EGFR T790M 突变阳性非小细胞肺癌(NSCLC)。除EGFR除了靶点,艾维替尼还可以靶向 BTK,通过与BTK抑制受体的不可逆结合B恶性细胞存活所需的受体磷酸化,如淋巴细胞和前列腺癌。
20149月,艾维替尼同时获奖NMPA和FDA临床试验批准;2018年6月,艾维替尼完成了中国注册临床研究,并向中国注册临床研究,NMPA提交上市申请,同年 8月纳入优先审查。这是国内第一个申请上市的三代人。EGFR抑制剂,比翰森制药的阿美替尼早了近一年,比艾力斯的伏美替尼早了一年半。这两个人。EGFR-TKI分别于2019年4月和12月申报上市。
艾维替尼国内项目重要节点概览
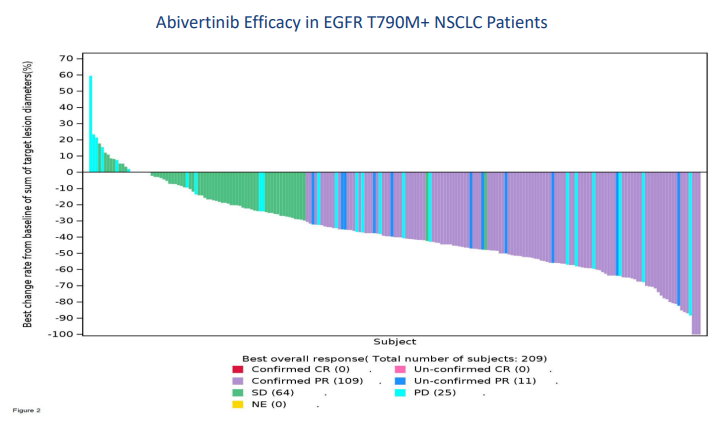
艾维替尼在中国申报上市的基础是 II 期临床研究结果,在 2019年 6月举行的 ASCO 年会上公布了这一临床结果;2022年 3月,临床试验结果发表于 Clinical Cancer Research 期刊mgBID)在治疗 209 的受试者中,93.3%(195/209)靶病变明显缩小,确认 ORR 为 52.2%(109/209)(OS)24.9 个月。
艾维替尼 NSCLC 临床数据
然而,在 2019年 7月进入第一轮补充信息任务后,艾维替尼的评价进展长期停滞不前。Insight 数据库 显示,直到2022年4月29日,上市申请才离开补充任务队列。在此期间,阿美替尼和伏美替尼已获批上市,并通过谈判进入医疗保险目录。EGFR-TKI 大混战也开始打响。
第三代 EGFR-TKIs 主要针对一二代 EGFR-TKIs 的 T790M 耐药突变Insight 内部检索数据库 EGFR-T790M可见,目前国内已有 28 三代 EGFR 抑制剂项目,除了 3 上市外,还有 5 上市申请,今年至少有2 品种批准,竞争模式变得白热,未来批准企业有多少市场机会尚不清楚。
国内「EGFR-T790M」竞争格局
但是,作为 EGFR/BTK 双靶点 TKI,艾维替尼还有其他三代 EGFR-TKI 所没有的适应症发展潜力。从肿瘤领域来看,Insight 数据库显示,艾维替尼在中国也开发了淋巴瘤适应症,国外刚刚启动了联合阿比特龙治疗去势抵抗性前列腺癌的 2 临床试验(NCT05361915)。
甘特图
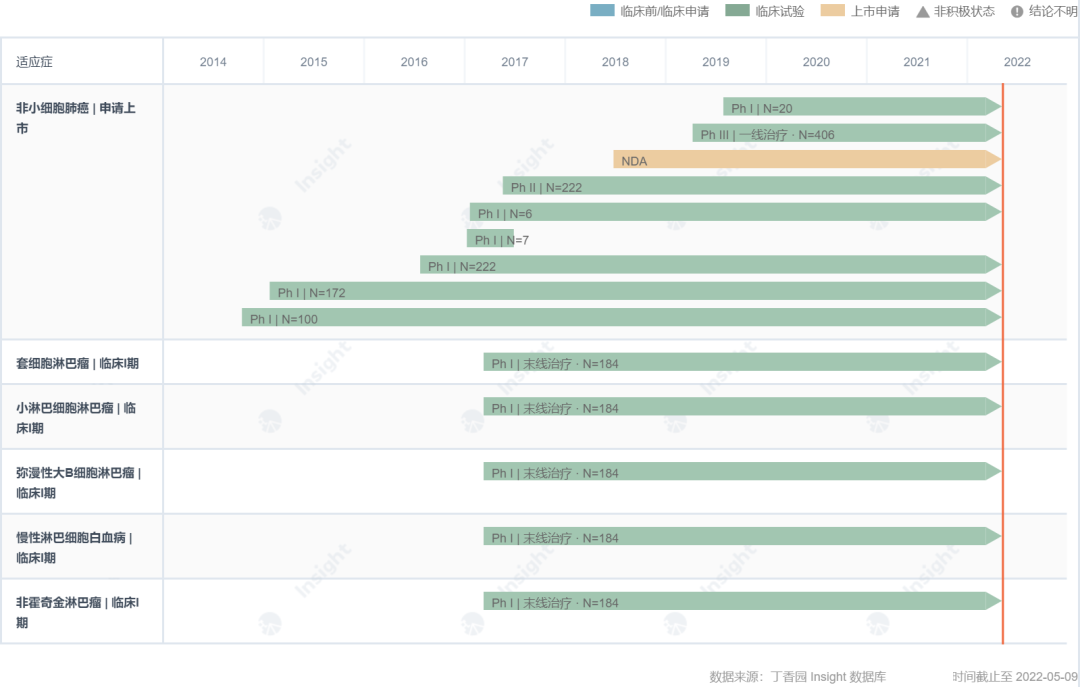
来自:Insight 数据库 (http://db.dxy.cn/v5/home/)
该药针对 B 细胞淋巴瘤的初步临床数据已经公布:
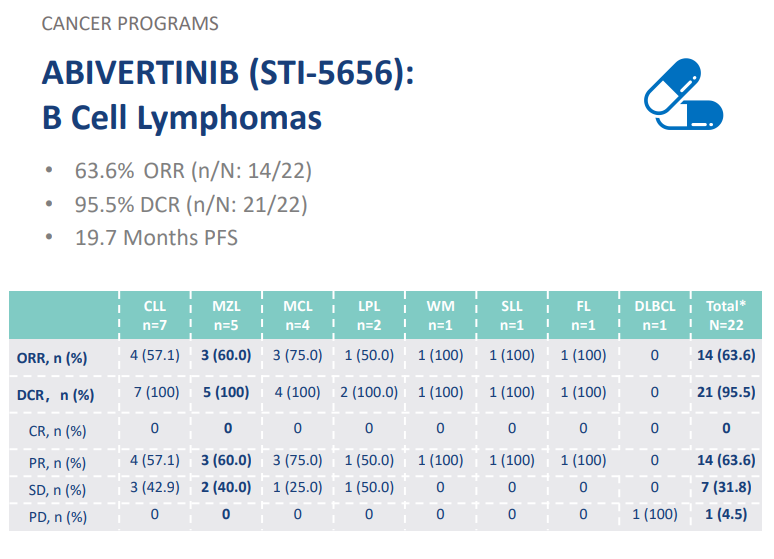
来自:Sorrento 公司
20205月,艾森医药与Sorrento正式签署合作协议,将艾维替尼在中国境外所有地区的适应症授权给 Sorrento。2021年4月,Sorrento 宣布收购艾森医药作为收购对价。合并结束时,艾森医药股东将获得总额3800万美元的 Sorrento 普通股,除上述对价外,在实现某些临床和销售里程碑的前提下,Sorrento 还将支付给艾森医药股东4.5 1亿美元的额外付款,也意味着 Sorrento 将为此次并购支付 4.88 亿美元(约合人民币 32 亿)。
Sorrento此前表示基于对 NSCLC 适应症更成熟的长期数据独立审查,预计未来将与 一起进行FDA 召开 pre-NDA 会议期望艾维替尼在美国报告 NDA;艾维替尼新冠肺炎适应症的发展,Sorrento 也寄予厚望。
另辟蹊径,
艾维替尼能在新冠治疗中开花结果吗?
观察 Sorrento 公司管道可以看出,艾维替尼是新冠治疗项目中进展最快的两种产品之一。3 月底,美国 FDA 已批准该药用于住院重症 COVID-19 患者关键 2/3 期临床。
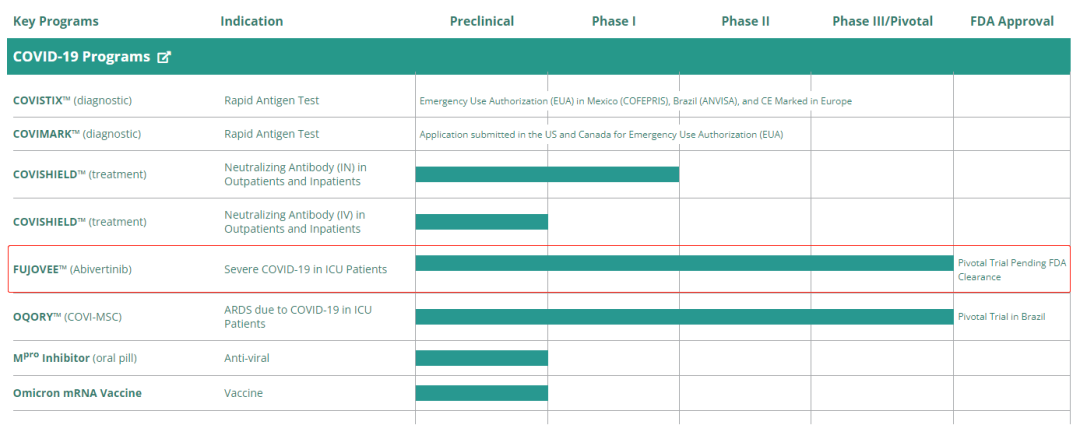
从项目覆盖的角度来看,公司通过引进合作获得的多个新冠治疗项目涵盖了预防、检测、治疗和康复治疗的不同阶段。
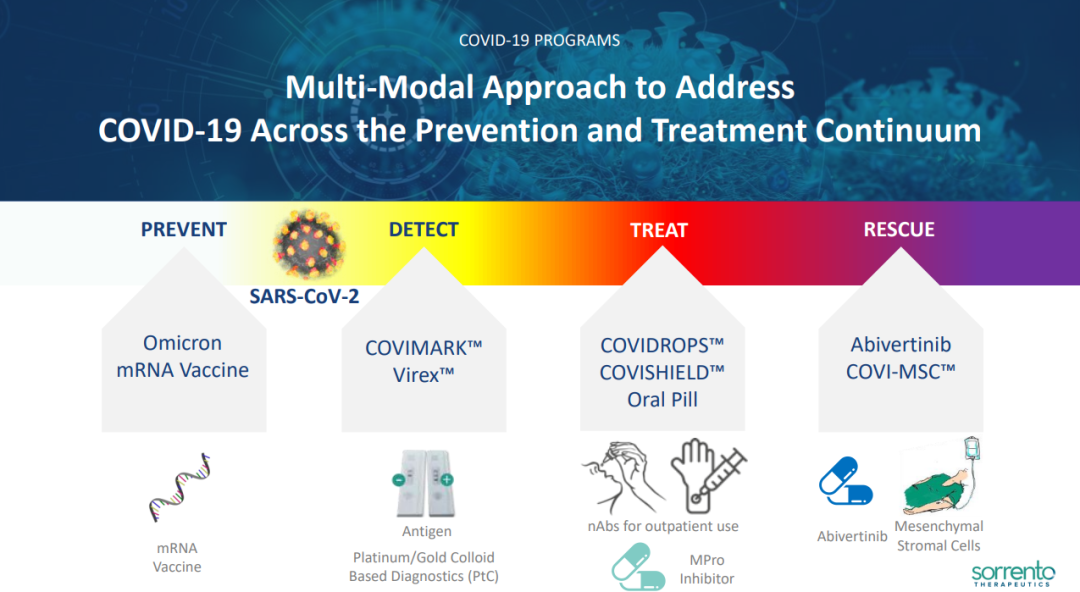
来自:Sorrento 公司
艾维替尼在体外表现出强烈的免疫调节活性,能有效抑制关键促炎细胞因子 IL-1β、IL-6 和 TNFα 的产生,以及由新冠或非新冠引起的急性呼吸窘迫综合征(ARDS)细胞因子释放综合征(CRS)相关。这与其他 有关BTK 抑制剂开发 COVID-19 适应症的机制基础是一致的。
去年 10 月,两次 2 期临床试验的初步结果已经公布。这两项研究分别在美国(N=96)和巴西(N=400)结果显示,高风险 COVID-19 患者服用艾维替尼后一个月内死亡率和呼吸衰竭比例明显下降。与对比相比,美国的研究有所改善。[78.3% 对 58.3%]巴西研究改进 25% [69.6% 与 44.4%]。美国临床研究中的高危患者 ICU 住院时间,艾维替尼组比对照组提前 2天出院(8.6 天 VS 10.6 天)。
3 月 31日,基于 2 期临床试验数据,美国FDA 已批准开展艾维替尼治疗重症住院病人的国际多中心 2/3 期临床。

聚焦到 BTK 靶点药物在新冠领域的发展,据 Insight 数据库 显示,包括艾维替尼在内的全球已已经有了 6 BTK 抑制剂启动了相应的临床试验,但大部分活跃期在 2020年。包括已批准上市的 BTK 抑制剂泽布替尼(百济神州)、阿卡替尼(阿斯利康)、伊布替尼(强生制药)、临床开发阶段 M7583(默克)、DWP 212525(大熊制药)。
新冠适应症 BTK 抑制剂研发进展
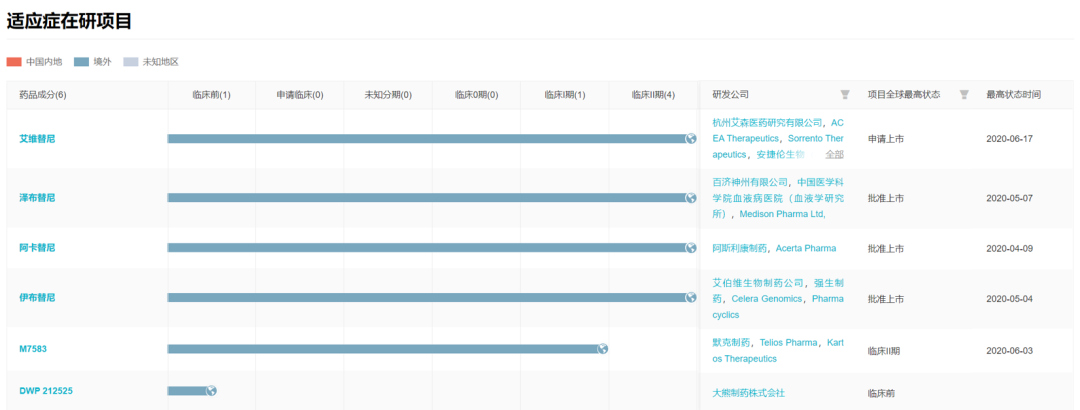
数据来自:Insight 数据库 全球新药(http://db.dxy.cn/v5/home/)
BTK 抑制剂针对 COVID-19 的发展并非一帆风顺,2021年 4月,百济神州宣布泽布替尼 用于新冠肺炎 2 期临床试验 BGB-3111-219(NCT04382586)未能达到无呼吸衰竭生存或吸氧天数减少的并列主要有效终点。本研究始于 2020年5月,进入 67例需要辅助氧气或机械通气的新冠肺炎患者,旨在快速评估泽布替尼治疗呼吸窘迫新冠肺炎住院患者是否有效。
作为三代EGFR 抑制剂,艾维替尼能否在中国获批上市?作为一种抑制剂,艾维替尼能否在中国上市?BTK抑制剂能否成为第一个COVID-19 III临床上成功的药物?都需要时间来证明。
