治疗单纯疱疹病毒感染 新机制疗法在我国获得临床批准
4月15日,中国国家食品药品监督管理局药品评价中心(CDE)官网公示,AiCuris Anti-infective Cures公司(以下简称AiCuris公司)申报pritelivir薄膜包衣片获得临床试验默示许可,用于治疗免疫力低下、对阿昔洛韦耐药的皮肤粘膜单纯疱疹病毒(HSV)感染。公开资料显示,pritelivir(AIC316)是一种全新的机制HSV复制抑制剂目前正处于国际多中心三期临床试验阶段。此前,该药曾获美国奖。FDA授予突破性疗法。
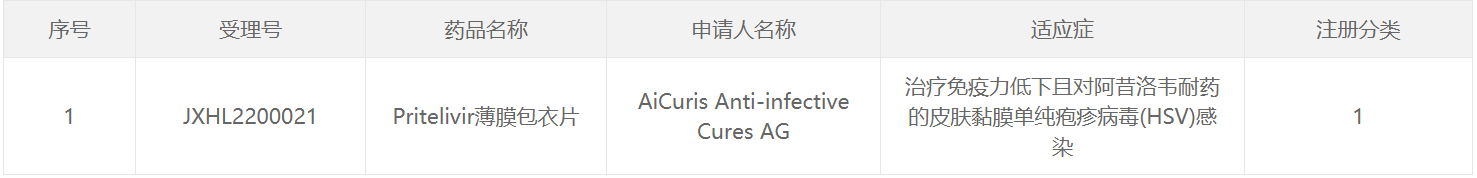
截图来源:CDE官网
单纯疱疹病毒一般分为HSV-1和HSV-2两类,其中HSV-1感染口腔、面部和生殖器,HSV-2主要感染生殖器。无论哪种类型,它们都会长期潜伏在人体内。当人体免疫力低下时,可能侵入皮肤、口腔、眼睛等部位,引起水泡、溃疡等剧烈疼痛症状。根据世界卫生组织官方网站,HSV-1潜伏在世界近70%的人体内,2016年50岁以下感染人数达到37亿。因此,这一领域的疾病负担更为严重。
Pritelivir正是AiCuris公司开发的一个HSV复制高效抑制剂。公开资料显示,AiCuris公司成立于2006年,最初由拜耳创立(Bayer)公司抗感染部门致力于开发严重危及生命的传染病创新药物。Pritelivir它属于一个新的化学类别,通过一种新的作用机制,即抑制病毒解旋酶-引物酶复合物起作用。与目前使用的核苷类似物相比,该药物不需要激活病毒酶,因此可以保护未感染的细胞。目前正在开发用于治疗免疫损伤和对阿昔洛韦耐药或双重耐药(对阿昔洛韦耐药,对膦甲酸钠耐药或不耐受)的药物HSV感染。
Pritelivir目前正在一个名字PRIOH-1国际多中心临床试验的2/3期接受评估。本研究旨在评估。pritelivir皮肤粘膜免疫功能低下,阿昔洛韦耐药HSV感染的疗效和安全性。本研究针对的适应症也是该药物在中国获批的临床适应症。
PRIOH-1早期试验第二阶段的部分结果表明,在接受过程中pritelivir治疗后28天内,受试者皮肤病变愈合的结果令人鼓舞,与接受膦甲酸钠治疗的受试者相比表现出临床相关差异。在对膦甲酸钠耐药或不耐受且治疗选择有限的患者中也观察到了疗效。pritelivir在研究中表现出良好的安全性和耐受性,试验期间因不良事件未提前中止pritelivir治疗。
基于二期临床试验的积极结果,AiCuris公司决定继续进行关键的的第三阶段临床试验,并将作为未来提交该药物上市申请的基础。据报道,第三阶段基于第二阶段的研究和设计,将在特定时间内比较受试者的皮肤病变愈合,并计划在美国、欧洲、中国等国家和地区的70个研究中心纳入128名患者。
参考资料:
[1]中国国家食品药品监督管理局药品评审中心(CDE)官网.Retrieved Apr 15,2022.From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]AiCuris公司官网管线介绍.From https://www.aicuris.com/87
