如何把握新药研发?CMC关卡?
作者:冲鸭
新药研发是一个漫长、复杂、多样化的过程。
从靶向模型研究、主导化合物的发现和优化、药物临床前和临床研究、药品注册申报到最终产品上市,每个层次都如履薄冰。
化学、制造和控制药物(Chemical Manufacturing and Control,CMC),它是产品成功开发和注册上市的关键要素之一。
与仿制药相对明确CMC研究不同,创新药物的研发具有很大的不确定性,特别是对于新疗法、罕见适应症、类似创新等主导创新药物,参考对象很少,部分指导原则仍在制定中。
但对于大多数新药研发公司来说,CMC研究是一个必要的过程;特别是在早期新药项目进行必要的评价,探索合适的合成工艺路线,开发合适的制剂工艺,合理的专利布局,有效管理和利用药品生命周期,最大化商业价值。
创新无缝连接源CMC,再到临床转成为加快新药研发的关键环节。
CMC研究与新药研发规律
新药研发需要经历靶点发现、临床前研究、临床研究、上市申报等阶段。
在每个阶段,都需要不断回答:这个项目值得继续发展吗?
随着研究阶段的深入,目标化合物随时可能被放弃。
挑战重重的尴尬局面,CMC如何适应新药研发规律?不同研究阶段?CMC研究的重点是什么?
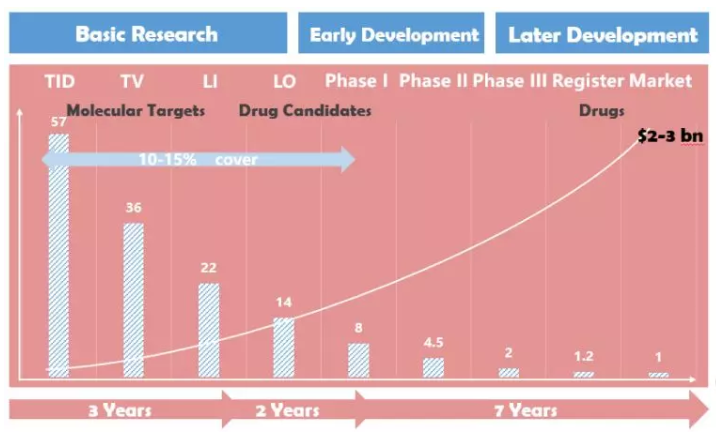
图1 新药研发历程及各阶段小分子化合物数量占比(%)
(资料来源:Roche,清华大学医学院)
数据显示,新药研发从药物靶点发现到靶点确认的阶段比例为36%,进入先导化合物筛选阶段的比例为22%,进入先导化合物筛选阶段的比例为36%。Drug Candidates(pcc)进入临床阶段的概率为14%I进入期的比例为8%,进入期的比例为8%II期临床概率为4.5%,进入III期临床概率为2%,进入到上市注册环节的概率为1.2%。
药物早期研发阶段也是淘汰率最高的阶段。图1显示,本阶段淘汰率在本阶段。90%以上。
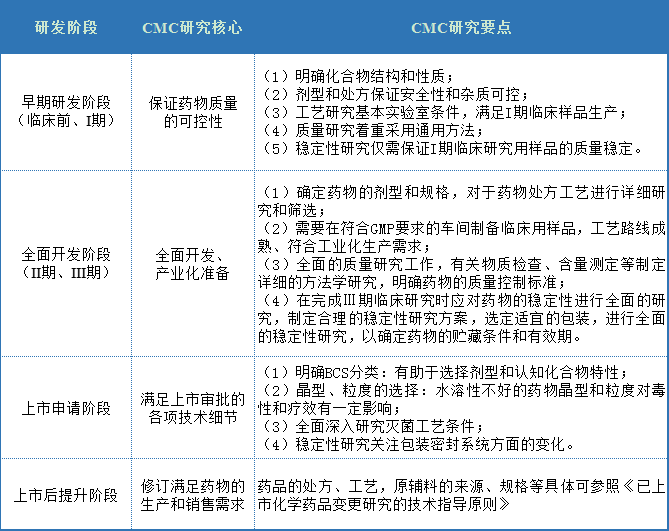
在进行I期临床研究患者少,周期短,因此CMC研究主要保证药物质量的可控性。只要能保证稳定性研究,I临床研究质量稳定。同时,由于临床试验在临床初期非常严格,药物的安全性也得到了保障。
综合开发阶段一般包括综合开发阶段Ⅱ期和Ⅲ本阶段通过对化合物毒性和疗效的综合研究,充分了解拟开发化合物的开发价值。
在本阶段的研究中,CMC一般来说,需要适当地改变药物的剂型、处方和规格,以达到降低毒性、提高疗效的目的,这是新药研发中非常重要的一个方面。如果剂型选择不当会导致药物开发失败,剂型选择应根据药理毒理学和临床研究结果确定,并结合化合物的性质确定。同时,合理规格的选择也必须根据相关的药理毒理学和临床研究结果来确定。需要注意的是,如果处方、工艺或使用的原材料发生变化,应进行相关的桥接试验。质量研究和稳定性研究根据药物和剂型的特点进行综合考虑。
上市审批阶段,通过前面的渐进式CMC研究充分了解药物的价值。权衡利弊后,需要比较药品上市的指导原则、法规和技术细节,完善前期研究材料,供上市审批。
在上市后阶段,由于各种原因,药品的处方、工艺、原材料的来源和规格将发生相应的变化。具体要求可参照《上市化学药品变更研究技术指导原则》。
表1 各阶段CMC研究的重点
CMC常见风险和对策研究
CMC研究是一项涉及原料、制剂、辅料包装材料、质量控制等环节的系统工程。
CMC申报中常见的风险有:
- 原料:杂质没有明确定义,包括工艺杂质、制剂杂质、容器中浸出的杂质或残留溶剂;对原料药了解不够;遗传毒性研究不足;缺乏与药物安全相关的临床和临床前评价;方法和放行标准不适用。
- 制剂:处方组成中对辅料了解不够;方法和放行标准不适用;没有足够的稳定性数据支持临床周期;设备适用性;包装材料的相容性等。
- 辅料包材:辅料包材缺乏说明;与药物的相容性;标准问题(USP/NF;FDA非活性成分数据库CP标准可能存在问题;供应商信息(Ⅲ期满后,供应商变更后标准是否发生变化);创新辅料问题;动物辅料来源问题(如疯牛病风险)。
- 质量研究与稳定性:杂质的合理限制;代谢物等质量控制结果是否与临床结果相结合;稳定性研究是否考虑上市国家和地区的气候;储存条件和包装是否考虑主要目标市场的气候条件。
因为CMC研究涉及的知识面很广,对策上很难有全面的策略。以下思路应考虑研究过程:
- 原料:充分研究化合物的性质。一方面,全面了解化合物的性质可以为剂型、处方、合成过程的选择提供重要依据;另一方面,明确化合物的结构,可以保证化合物的稳定性,减少杂质的引入,明确遗传毒性。此外,确定初始原料和试剂或有机溶剂的来源和规格,制定初始原料的内部控制标准,根据可能产生的副产品优化反应条件减少杂质的产生,确定中间体的控制标准。
- 制剂:由于药物的处方和规格相对明确,需要详细研究制剂过程,提前发现放大过程中的差异,确定关键过程的参数,为未来的商业生产做好充分准备。
- 辅料包装材料:在充分考虑安全因素的前提下,制定购买、储存、发放、使用临床试验药品所用原辅料和包装材料的管理规定,建立相关供应商规定。
- 质量控制:在综合开发阶段,可尽可能参考仿制药CMC质量研究的过程和规范。药物中的杂质需要定性和定量,限制应根据相关研究结果确定。为了调查方法的可行性,需要对相关的物质检查和含量测定进行详细的方法研究。同时,根据药物的特点、处方和工艺制定药物质量控制标准。
结语
不用说,原创新药在于CMC从发达国家原创新药的发展历史可以充分证明,开发确实存在诸多不可把握的风险。
同时,对于创新药物CMC研究表明,它不是一个简单的线性模型,而是一个具有聚集性和开放性的生态系统。
在变化的时代,相信CMC在研究的各个阶段,准确性、对力和良好的力量肯定会事半功倍,为新药的研发提供巨大的动力。
