PROTAC联合CRISPR在这个抗癌领域,筛选 很有前途
以PROTAC靶向蛋白降解疗法是新药开发的热门领域之一。据不完全统计,今年已有24种靶向蛋白降解疗法进入临床开发阶段。最近,邓迪大学(University of Dundee)的Alessio Ciulli教授团队发表综述,盘点使用情况PROTAC治疗,靶向表观遗传学靶点的现状,并展望未来。作者说,CRISPR筛选与PROTAC技术的结合为蛋白质降解疗法的开发提供了有力的工具。Ciulli教授也是一家初创公司Amphista Therapeutics科学创始人,去年完成了5300万美元B轮融资致力于开发下一代靶向蛋白降解平台。

表观遗传学在疾病病理中的作用
表观遗传学包括对表观遗传学DNA、DNA相关蛋白质,以及RNA这些修饰并没有改变基因序列,而是影响了基因的表达。例如,对于,对于,对于,对于基因的表达。DNA甲基化与基因沉默有关,转录调节中对组蛋白的许多修饰,DNA复制修复,RNA在剪接和染色体凝结过程中起着重要作用。
表观遗传学在疾病病理中的作用早已确立,如组蛋白脱乙酰酶(HDACs)高度表达在癌症中。表观遗传学蛋白的功能缺失或获得性突变也经常驱动疾病病理学。历史上,表观遗传学抑制剂的开发也取得了成功。目前,美国已有7种靶向表观遗传学蛋白抑制剂FDA批准上市。最近批准的一种新药是第一种靶向组蛋白赖氨酸甲基转移酶EZH2的抑制剂tazemetostat。
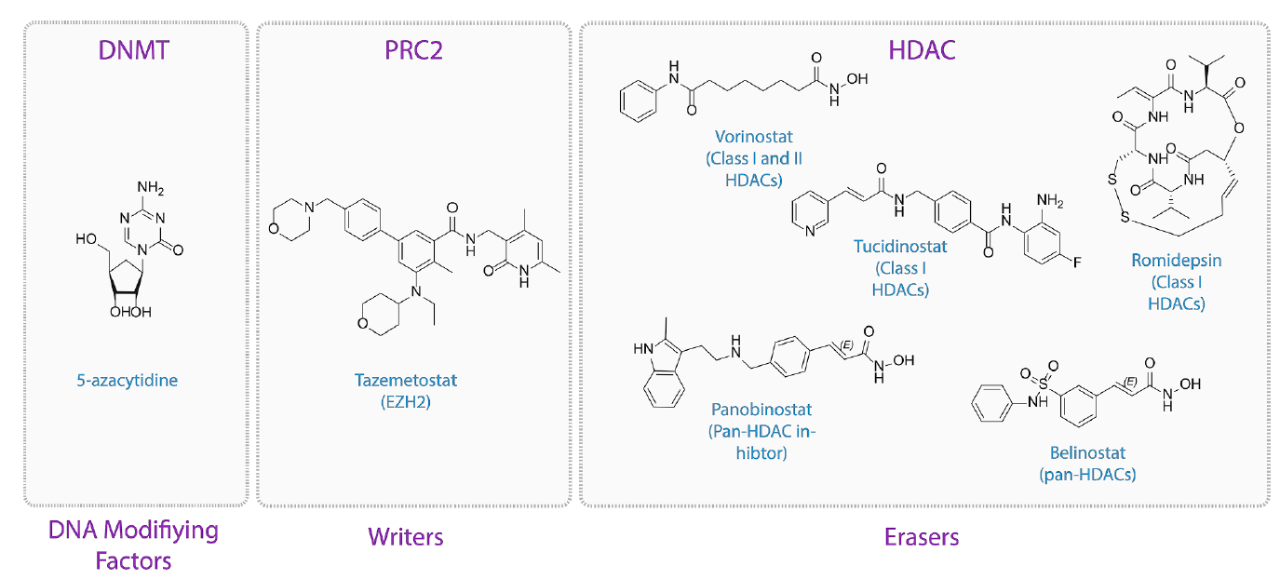
▲获得FDA批准靶向表观遗传学蛋白抑制剂(图片来源:参考资料[1])
然而,面对多重挑战,开发靶向表观遗传蛋白抑制剂的主要限制之一是许多表观遗传蛋白家族的催化蛋白域或蛋白质-蛋白质相互作用的结构高度保守,这使得开发针对特定亚型的抑制剂非常困难。一个典型的例子是,BET蛋白质。抑制剂应用的另一个限制是,表观遗传学蛋白通常含有多个蛋白域,通常是由多个亚基组成的蛋白质复合体的一部分。这些特征意味着使用抑制剂来阻止单一催化活性或相互作用,这不足以改变复合体的功能结果,因为有许多其他活性或相互作用不受抑制剂的干扰。
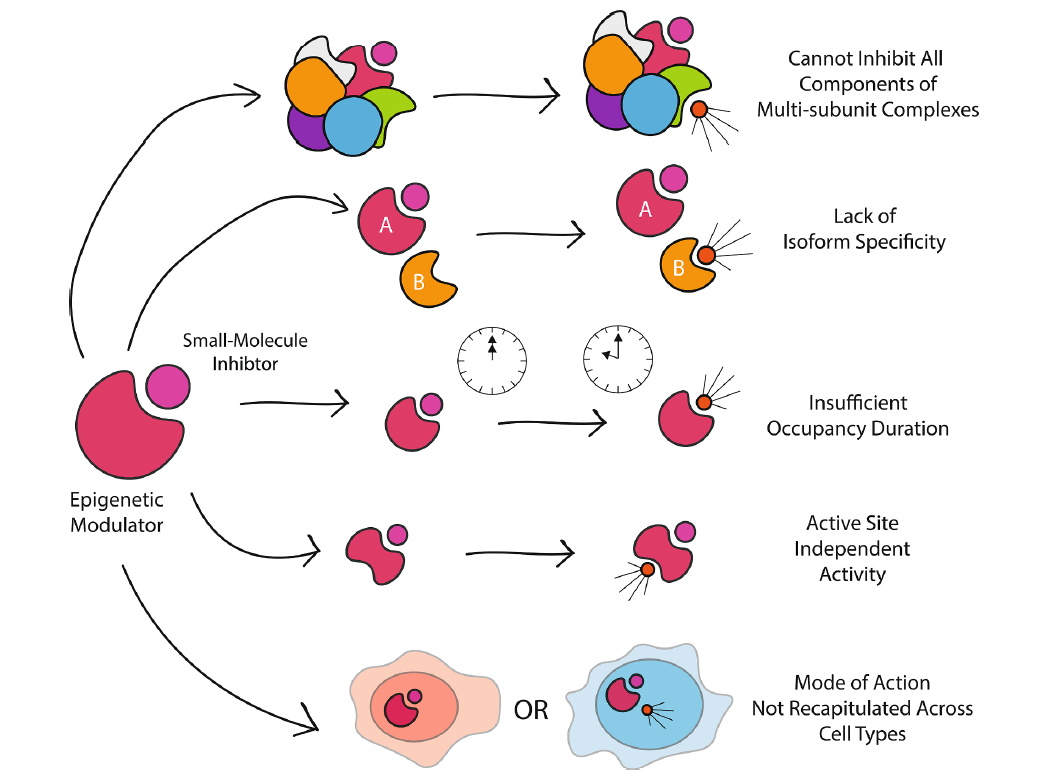
▲开发小分子抑制剂调节表观遗传学的挑战(图片来源:参考资料[1])
遗传筛选带来的突破
基于RNA干扰(RNAi)和CRISPR基因编辑技术的遗传筛选给表观遗传学的靶点发现带来了革命性的变化。这些技术使科学家能够系统地降低或去除基因组中单个基因的表达,从而发现表观遗传学蛋白的缺失,以及哪些疾病对表观遗传学蛋白的流失特别敏感。例如,使用RNAi筛选发现急性髓系白血病细胞BET蛋白Brd4活动的关键依赖性。以及最新的。CRISPR筛选与RNAi相比之下,它可能提供更低的脱靶效应和更广泛的应用范围。CRISPR筛选可以设计靶向基因亚群,如表观遗传因子。
不过,虽然CRISPR和RNAi筛选可以发现和验证值得注意的目标,但这些目标的抑制剂往往不能复制目标去除的表单。因为抑制靶蛋白活性和去除靶蛋白表达有不同的作用机制。这给靶蛋白降解疗法带来了机会。
靶向蛋白降解疗法是靶向表观遗传学靶点的重要工具
PROTAC蛋白降解疗法利用细胞泛素-蛋白酶系统特异性降解靶点蛋白。这些分子通过靶点蛋白和靶点蛋白和靶点蛋白。E3连接酶拉近并形成三元复合体,导致靶蛋白泛素化,然后被蛋白酶体识别并降解。过去的研究表明,PROTAC介导蛋白降解可以复制多个表观遗传学靶点的表型,通过遗传学敲除或筛选发现,而抑制剂往往无法实现。
表观遗传学蛋白通常构成多亚基复合体,以特定地修饰基因组。在靶向表观遗传学靶点方面,靶向蛋白降解是一种强有力的策略,因为对于含有多蛋白域的蛋白质,它可以针对最容易添加泛素的蛋白质域,即使这个蛋白质域没有活性功能,也会导致整个蛋白降解。在靶向多亚基蛋白复合体方面,它可以用来靶向最容易降解的亚基,而亚基的去除可能会导致整个复合体的不稳定和降解,靶向蛋白降解剂也可能介导E3将泛素链添加到复合体中的非靶点蛋白中,导致整个复合体的降解。
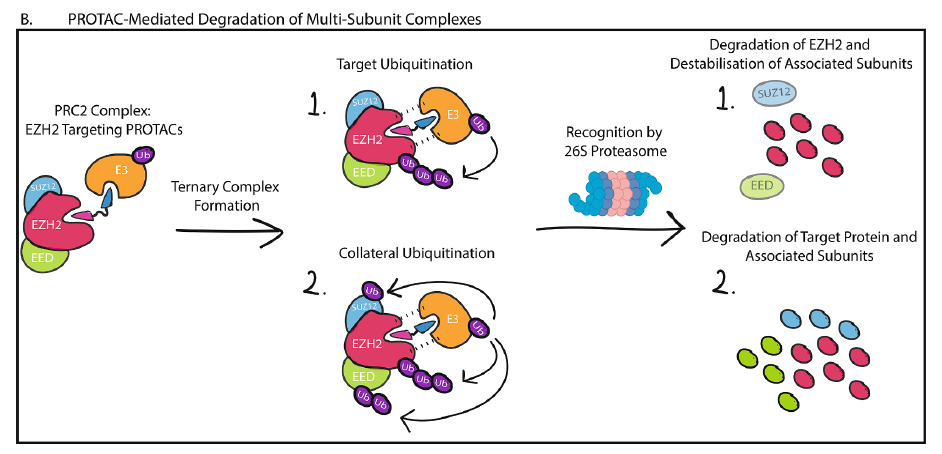
▲PROTAC介绍多亚基复合体降解方法(图片来源:参考资料[1])
靶向表观遗传复合体PROTAC分子
在综述中,作者描述了多种针对不同表观遗传复合体的目标PROTAC分子。名为SWI/SNF染色质重塑复合体在肿瘤和神经系统疾病中经常发生突变。针对这种复合体的不同亚基,科学家们开发了一系列PROTAC分子。其中包括选择性降解。BRD9和BRD7的降解剂VZ185,其发现证明,系统的降解剂迭代设计可以通过不断监测降解剂的细胞降解能力和三元结构的热动力学来开发高效的蛋白质降解分子,即使初始分子的降解特性很差。
开发靶向SMARCA2/4亚基降解剂的研究证明SMARCA2/4的同时,SWI/SNF复合体的其他亚基体也被清除了。这些研究强调了选择最容易降解的亚基体的可行性,导致了整个复合体降解开发策略的可行性。
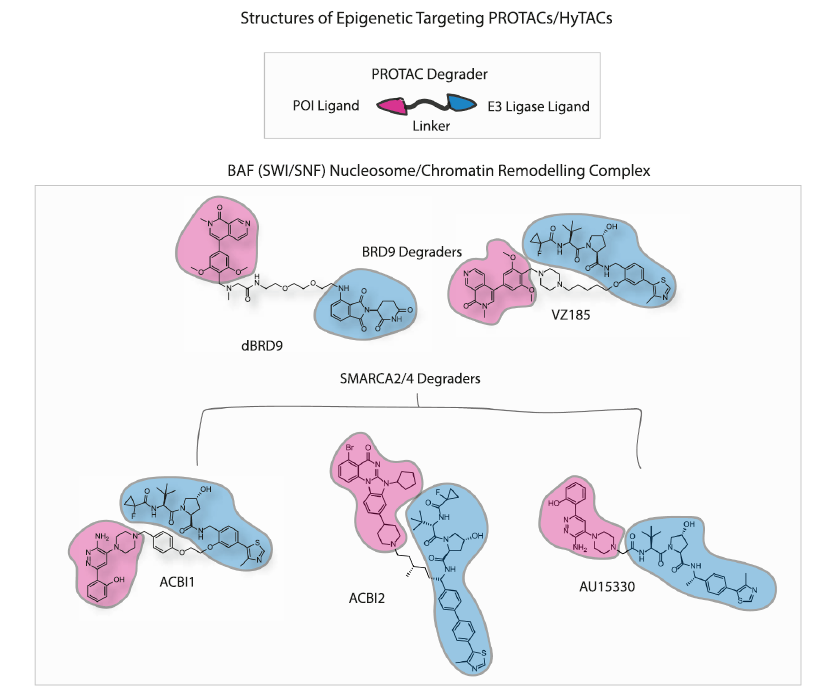
▲靶向SWI/SNF的多种PROTAC分子(图片来源:参考资料[1])
PRC2复合体是一组蛋白甲基转移酶,它催化H3K27的甲基化,PRC2近年来,复合体因其科学家的发现而受到关注EZH2亚基与癌症的进展有关。FDA批准的EZH2抑制剂tazemetostat为靶向EZH2对癌症的治疗进行了临床验证。
PRC2复合体由四个关键亚基组成,SUZ12,RbAp46,EZH1/2和EED。许多针对这种复合体的蛋白质降解剂已经开发出来,它们都表现出对特定亚基表达的选择性调整,或者导致所有的蛋白质降解剂PRC2亚基降解能力。其中,靶向,靶向。EZH2的PROTAC分子E7不仅在实验中有所改进EZH2泛素化水平也提高了EED和SUZ12亚基的泛素化水平。结果表明,PROTAC分子可导致复合体中未靶向亚基的泛素化,从而导致整个复合体的降解。
PRMT5它是一种精氨酸甲基转移酶,负责哺乳动物组蛋白基物的甲基化。PRMT5失控与各种预后不良的癌症类型有关,包括肺癌、乳腺癌和肝细胞癌。组织特异性降低实验的使用证明了这些类型的癌症PRMT5依赖性。目前,针对性。PRMT5许多小分子抑制剂已进入临床试验阶段,包括葛兰素史克、杨森和安进的在研疗法。然而,目前的小分子抑制剂已经进入临床试验阶段。PRMT5虽然抑制剂可以被抑制PRMT5甲基转移酶活性,但没有证据表明它们能抑制PRMT5骨架蛋白功能。PROTAC分子可能同时减少PRMT5骨架蛋白功能更有效地阻断PRMT5致癌作用。
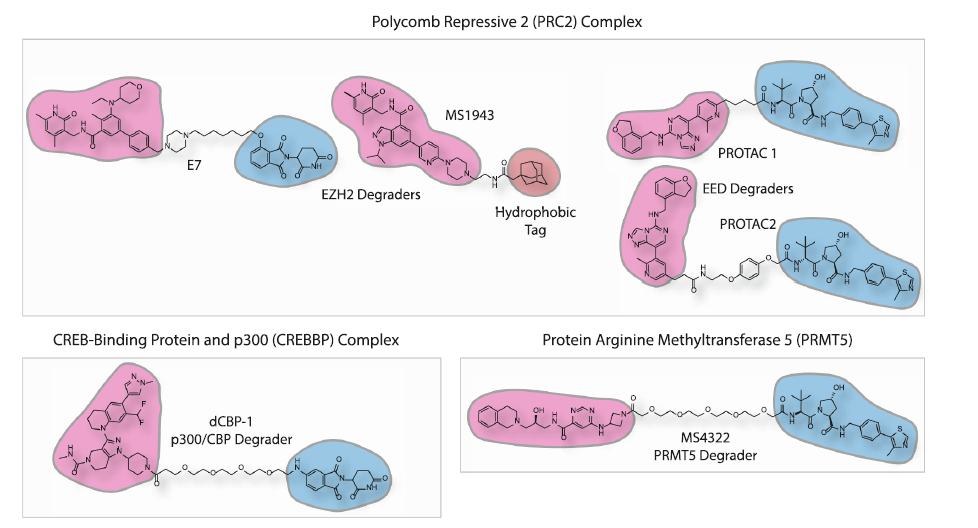
▲蛋白质降解分子(图片来源:参考资料[1])
总结与展望未来
综述作者指出,表观遗传失调与疾病病理学的联系已经得到证实,特别是对于预后不良的癌症类型。近年来,遗传筛查发现,许多特定类型的癌症对表观遗传调节因子的丢失特别敏感,但这些靶点的抑制剂通常不能复制或降低蛋白质的形状。PROTAC通过降解靶点蛋白,该技术可以更好地复制CRISPR或RNAi筛选发现的靶点表型。
靶向复合体中的一个亚基导致其他亚基的降解是一种常见现象。PROTAC分子可以表现出比预期二元结合更高的靶向降解选择性,这意味着降解剂可能比抑制剂更有选择性,从而扩大治疗窗口,提高药物的安全性。
展望未来,作者说,在当前的研究中发现了它PROTAC分子尚未经过广泛的药物化学优化。正在进行中。PROTAC当确认了生物学机制和靶向表观遗传学靶点的优势时,作者认为,启动更广泛的药物化学工作将是将这种治疗模式转化为临床候选治疗的下一步。
目前,靶向表观遗传学靶点Brd9的PROTAC降解剂CFT8634(C4 Therapeutics)和FHD-609(Foghorn Therapeutics)即将或已进入临床实践。作者说,未来几年无疑会有更多的时间。PROTAC降解剂针对更多的表观遗传学靶点。
参考资料:
[1] webb et al.,(2022). Targeting epigenetic modulators using PROTAC degraders: Current status
and future perspective. Bioorganic
