创新ADC治疗难治性卵巢癌达到三期主要临床终点
2022年3月21日,ImmunoGen公布了靶向叶酸受体α(FRα)抗体偶联药物(ADCs)mirvetuximab soravtansine(下称“mirvetuximab一个关键的三期临床试验的所有结果。试验结果显示,在治疗晚期卵巢癌患者中,含铂疗法耐药,mirvetuximab单药治疗具有临床抗肿瘤活性、一致的安全性和良好的耐受性。这些患者过去接受过血管内皮生长因子(VEGF)贝伐珠单抗抑制剂(bevacizumab,英文商品名称Avastin)治疗,并高度表达FRα。根据目前的结果,该公司计划本月前往美国FDA提交生物制品许可证申请(BLA)。
卵巢癌患者对含铂疗法的耐药性是成功控制疾病的重大挑战。FRα它是叶酸受体家族的一员,以高亲和力与叶酸结合,导致它们被吞入细胞。之前的研究表明,FRα在76-89%的上皮卵巢癌和35-68三阴性乳腺癌高度表达%。FRα成为一个值得关注的药物靶点。FRα介导的信号通路会影响肿瘤细胞的分裂和迁移,从而抑制肿瘤细胞的分裂和迁移FRα也可能产生一定程度的直接抗癌活性。
Mirvetuximab将与FRα人源化单克隆抗体与能产生细胞毒性的抗体相结合DM4通过二硫键连接分子。ADC与FRα结合之后,FRα能够将ADC转移到细胞内,ADC携带细胞毒性分子,抑制肿瘤细胞的有丝分裂。
三期临床试验入组106例肿瘤表达高水平FRα含铂药物耐药卵巢癌患者,患者中间治疗线为3线,均接受贝伐珠单抗治疗。试验达到主要终点,经研究人员评估确认的客观缓解率(ORR)为32.4%(95% CI:23.6%,42.2%),包括5例完全缓解(CR),以往的治疗线数或以往的治疗线数PARP抑制剂(PARPi)治疗无关。中位缓解持续时间。(DOR)截至2022年3月3日,研究3月3日,研究人员评估中位DOR为6.9个月(95% CI:5.6,8.1)。此外,研究人员评估的中位无进展生存期(PFS)为4.3个月(95% CI:3.7,5.1)。
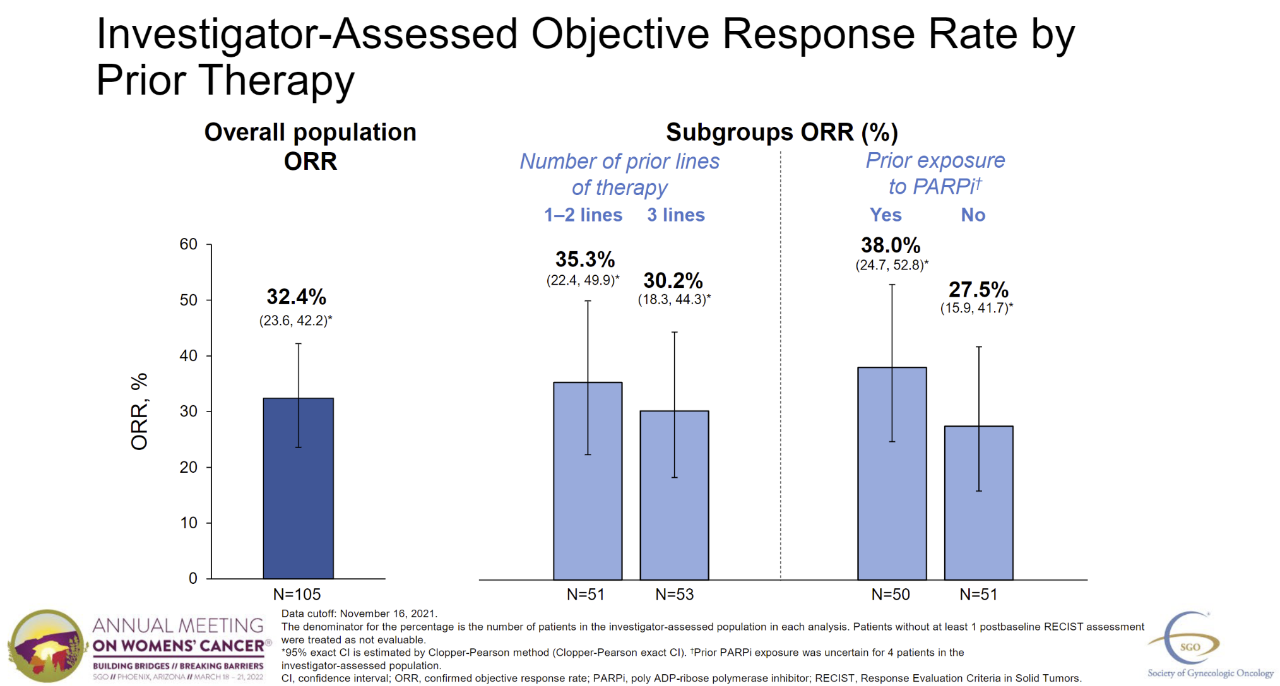
图片来源:参考资料[2]
安全性上,mirvetuximab良好的耐受性与以往研究中观察到的已知安全特征一致。最常见的治疗相关的不良事件是轻度和可逆的,包括视力模糊、角膜病变和恶心。
基于本实验中观察到的抗肿瘤活性、缓解持久性和安全性,我们认为mirvetuximab它可以代替化疗单药治疗FRα对铂耐药卵巢癌的标准治疗潜力表达较高。ImmunoGen高级副总裁兼首席医学官Anna Berkenblit有了这些积极的结果,我们希望在本月提交mirvetuximab的BLA,支持今年在美国的潜在加速批准。我们正在进行的另一项验证性三期临床试验预计将在今年第三季度获得,旨在支持mirvetuximab潜在的完全批准。
参考资料:
[1] ImmunoGen Presents Full Results from Positive Pivotal SORAYA Trial of Mirvetuximab Soravtansine in Ovarian Cancer at SGO Annual Meeting. Retrieved March 21,2022,from https://www.businesswire.com/news/home/20220319005002/en/ImmunoGen-Presents-Full-Results-from-Positive-Pivotal-SORAYA-Trial-of-Mirvetuximab-Soravtansine-in-Ovarian-Cancer-at-SGO-Annual-Meeting
[2] Efficacy and Safety of Mirvetuximab Soravtansine in Patients With Platinum-Resistant Ovarian Cancer With High Folate Receptor Alpha Expression: Results From the SORAYA Study. Retrieved March 21,2022,from https://www.immunogen.com/wp-content/uploads/2022/03/SGO-2022_SORAYA_Oral-Presentation_Matulonis_vF-1.pdf
