阿斯利康的两种新药在中国被批准为临床 CD73、NKG2A
3月17日,中国国家食品药品监督管理局药品评价中心(CDE)官方网站显示,阿斯利康(AstraZeneca)两种一类新药获得临床试验默示许可,即抗药CD73抗体oleclumab及抗NKG2A抗体monalizumab,拟开发适应症均为:与抗抗抗开发适应症均为:PD-L1抗体度伐利尤单抗(Imfinzi)联合使用,治疗局部晚期,不能切除非小细胞肺癌(NSCLC),这些患者在同步放化疗后没有进展。
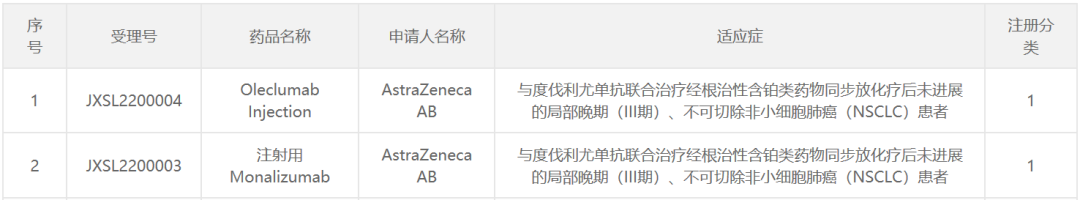
截图来源:CDE官网
CD73和NKG2A都是肿瘤免疫疗法的新靶点。
其中,CD73催化单磷酸腺苷(AMP)向腺苷转化的限速酶广泛表达在基质内皮细胞和肿瘤细胞表面。水解环境中的单磷酸腺苷去除磷酸基团,在肿瘤环境中产生大量具有抑制免疫功能的腺苷分子。根据阿斯利康的公开信息,oleclumab是一种潜在的潜在first-in-class”的抗CD73单克隆抗体可选择性结合,抑制和抑制CD73活动。目前,,,oleclumab正在对各种恶性肿瘤进行两期临床试验。
NKG2A它被认为是一种潜在的免疫检查点抑制剂靶点。它正在进行中。T细胞和自然杀伤细胞(NK细胞)表面很多表达,而细胞表面有很多表达,NKG2A与配体的结合会抑制T细胞和自然杀伤细胞的功能。研究表明,抑制抑制。NKG2A与配体的结合有望释放免疫细胞的活力。
公开资料显示,monalizumab是阿斯利康和Innate Pharma一种潜在的合作开发first-in-class”抗NKG2A抗体,对人NKG2A具有很高的特异性。在体外实验中,这种抗体表现出预期的效果,有效地提高了抗体的效果T细胞和自然杀伤细胞的抗肿瘤能力。目前,该产品被称为头颈鳞状细胞癌患者之一。INTERLINK-1三期临床试验。
2021年欧洲肿瘤内科学会(ESMO)在年会上,阿斯利康宣布了抵抗PD-L1抗体度伐利尤单抗作为单药,或与抗体度伐利尤单抗作为单药oleclumab或monalizumab联合使用,治疗局部晚期,不能切除III非小细胞肺癌患者的疗效和安全性。这些病人在接受放疗和化疗后没有进展。
二期临床试验中期分析结果显示,中位随访时间为11.5与度伐利尤单抗单药相比,度伐利尤单抗与度伐利尤单抗单药相比,oleclumab病人的病情进展或死亡风险降低56%;度伐利尤单抗和monalizumab结合将疾病进展或死亡风险降低35%。10个月内,三组受试者的无进展生存率分别为:度伐利尤单抗 oleclumab(64.8%)monalizumab(72.7%)(39.2%)。
阿斯利康曾在新闻稿中表示,研究结果表明,这些新组合可以进一步重新定义一些患者的治疗结果。它将是。oleclumab或monalizumab与免疫疗法伐利尤单抗结合使用后,可显著提高治疗效果,并具有良好的安全性。
