阿斯利康/默沙东MEK在中国申报上市的抑制剂
医学观澜
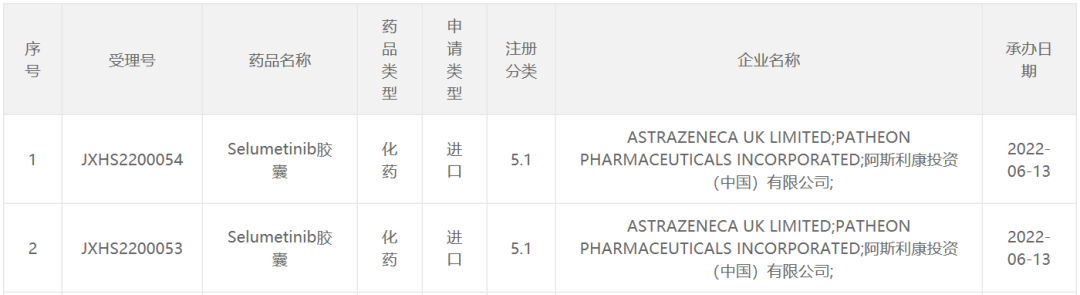
6月13日,中国国家食品药品监督管理局药品审评中心(CDE)官网最新公示,阿斯利康(AstraZeneca)递交了5.1类新药selumetinib该胶囊的上市申请已被接受,并已正式纳入优先审查。拟用于丛状神经纤维瘤,伴有症状,3岁及以上无法手术(PN)1型神经纤维瘤病(NF1)治疗儿科病人。公开资料显示,司美替尼(selumetinib)阿斯利康和默沙东(MSD)共同开发的公司MEK它也是世界上第一种治疗抑制剂NF这种罕见的疾病药物,在生命早期就使人虚弱。
司美替尼是一款MEK抑制剂,MEK是RAS/MAPK信号通路中的关键蛋白激酶。该产品可选择性抑制MEK1和MEK2、从而使失调的信号通路恢复正常,进而缓解儿童NF病人的病情。此前,该药物已在美国获得FDA孤儿药资格、突破性治疗资格和优先评价资格,适应症是治疗NF1.2020年4月,司美替尼获得FDA批准上市(商品名称为Koselugo),2岁及以上的治疗NF1儿童患者,这些患者携带丛状神经纤维瘤,表现出症状和/或进行性,无法通过手术治疗,成为第一种治疗方法NF1创新疗法。
根据阿斯利康和默沙东的公开信息,2017年7月,双方宣布在肿瘤领域达成全球战略合作,共同对抗世界第一PARP奥拉帕利及MEK抑制剂司美替尼在临床肿瘤适应症进行了临床开发和商业推广。双方将共同开发奥拉帕利和司美替尼与其他潜在新药的联合治疗和单一药物治疗方案。同时,两家公司还将独立开发奥拉帕利和司美替尼及其各自的公司PD-L1及PD-1抑制剂联合治疗方案。
在中国,斯美替尼已经获得了许多临床试验的默示许可,适应症是症状和/或进行性的,不能手术NF1.相关丛状神经纤维瘤的治疗。根据中国药物临床试验注册和信息宣传平台,阿斯利康正在开展一项国际多中心(包括中国)三期临床试验,以评估成年人治疗丛状神经纤维瘤的症状NF1受试者的有效性和安全性。
CDE官方网站还显示,以符合儿童生理特征的童生理特征的儿童药物新品种、剂型和规格为由被列入优先审查,拟用于3岁及以上丛状神经纤维瘤,伴有症状,无法手术NF治疗儿科病人。

截图来源:CDE官网
此前,美国国家癌症研究所进行的一项临床试验结果表明,司美替尼的治疗使丛状神经纤维瘤无法通过手术治疗NF1儿童患者总缓解率(ORR)达到66%,所有患者均部分缓解。在这些病人中,82%的病人缓解了12个月或更长时间。
NF1是一种罕见的、不可治愈的遗传性疾病,发病率约为1/3000新生儿。这种疾病是由于神经纤维瘤蛋白的合成NF1基因突变引起的这种基因突变可以干扰RAS/MAPK信号通路(RAS-RAF-MEK-ERK),这会导致肿瘤的生长。在20%~50%的NF在患者中,肿瘤在神经鞘上发展,导致丛状神经纤维瘤。
