驯鹿生物CAR-T接受产品新增自身免疫性疾病适应症临床申请
5月28日,CDE官方网站显示,驯鹿生物提交了两份伊基伦赛注射液临床试验申请,并被接受。根据驯鹿生物学新闻稿,伊基伦赛是一个完整的来源BCMA嵌合抗原受体(CAR)自体T细胞注射剂(研发代码)CT103A),本次申报的临床试验适应症是视神经脊髓炎谱系疾病的抗体介导。
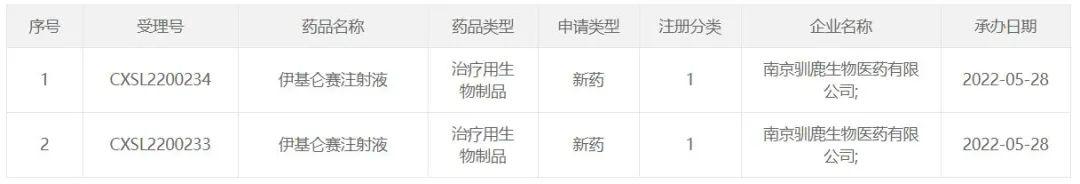
这是第一次在中国提交CAR-T细胞疗法治疗自身免疫性疾病的临床试验申请也是世界上第一个CAR-T临床试验申请治疗神经脊髓炎谱系疾病。
公开资料显示,CT103A它是一种由驯鹿生物和信达生物联合开发的靶向生物BCMA的CAR-T创新候选产品。以慢病毒为基因载体的候选产品转化为自体感染T细胞,CAR包含全人源scFv、CD8a铰链和跨膜,4-1BB共刺激和CD3ζ激活结构域。CT103A已获得CDE用于治疗复发性/难治性多发性骨髓瘤的突破性治疗品种。2022年2月,美国FDA授予CT103A治疗复发性/难治性多发性骨髓瘤的孤儿药资格。
本次,CT103A提交的临床试验申请是针对一种新的适应症——视神经脊髓炎谱系疾病(NMOSD)。视神经脊髓炎(NMO)中枢神经系统急性或亚急性炎性脱髓鞘疾病,是神经系统特发性炎症性疾病。NMOSD它存在于血清中NMO-IgG视神经脊髓炎和视神经脊髓炎相关疾病是抗体的标志。
新适应症的应用是基于伊基伦赛注射液研究人员的临床研究(Investigator Initiated Trial,IIT),研究组的受试者是难治性视神经脊髓炎谱系疾病患者,他们使用免疫抑制剂治疗至少一年,但症状控制不佳。本研究的主要目的是观察伊基伦赛注射液的治疗NMOSD受试者的安全性和耐受性,以及初步疗效和药代动力学(Pharmacokinetics,PK)、药物动力学(Pharmacodynamics,PD)相关指标。截至2022年3月20日,12名受试者接受了伊基伦赛注射液回输,其中00人.5×106 CAR-T细胞/kg剂量组3例受试者,爬坡阶段和扩展阶段1例.0×106 CAR-T细胞/kg3个剂量组和6个受试者分别接受了伊基伦赛注射液CAR-T细胞回输。
研究数据初步显示0.5×106 CAR-T细胞/kg与1.0×106 CAR-T细胞/kg伊基仑赛注射液用于治疗传统疗法控制不佳NMOSD受试者表现出更可靠的安全性,所有CRS(Cytokine Release Syndrome,细胞因子释放综合征)都是1-2级,没有观察到ICANS(Immune Effector Cell Associated Neurologic Syndrome,免疫作用细胞相关神经系统综合征)。在有效性方面,50%的受试者改善了视力,67%的受试者改善了行走能力,75%的受试者改善了直肠膀胱功能。
参考资料来源:医药观澜、美通社
