赛诺菲宣布移植新药Rezurock临床试验总结数据
编译丨newborn
最近,赛诺菲公布了Rezurock(belumosudil)治疗慢性移植物抗宿主病(cGVHD)临床试验的总结分析数据。结果表明,部分器官的临床缓解和患者报告结果(PRO)临床变化(改进)。
Rezurock由Kadmon Holdings2021年7月获得美国开发,FDA批准。2021年9月,赛诺菲以19亿美元收购Kadmon,Rezurock然后收入囊中。值得一提的是,Rezurock是美国FDA批准的第一款也是唯一一款ROCK2小分子抑制剂用于治疗系统治疗失败至少两次cGVHD儿科病人(年龄≥12岁)和成人病人。
cGVHD它是异基因干细胞移植后可能出现的并发症,发病率和死亡率并不乐观。cGVHD在此期间,移植的免疫细胞(移植物)攻击患者的细胞(宿主)会导致皮肤、口腔、眼睛、关节、肝脏、肺、食道和胃肠道的炎症和纤维化。据估计,美国大约有1.4万人cGVHD患者。
来自ROCKstar(KD025-213)和KD025-028研究的总结分析表明,在接受研究时,Rezurock在治疗患者中,器官临床缓解指标和PRO临床意义变化之间存在着很强的相关性,但也存在着普遍性。具体来说,报告于皮肤、口腔、眼睛、上消化道、肺(临床肺量表评分)和整体测量PRO临床意义的变化。这些数据支持在于。cGVHD临床试验和患者护理PRO为了帮助捕捉助捕捉病人的感受。
临床和PRO数据汇总分析包括参与两项Rezurock研究(n=132,KD025-213研究;n=54,KD025-208研究)的170名(91.3%)患者,这些患者进行了基线PRO评估,至少一次随访PRO、至少一个反应评估。中位年龄为。54.598岁(58%)为男性,之前治疗中位数为3次,70%患有严重疾病cGVHD,数据截止时间为15个月(范围为15个月)0.6-44个月)。
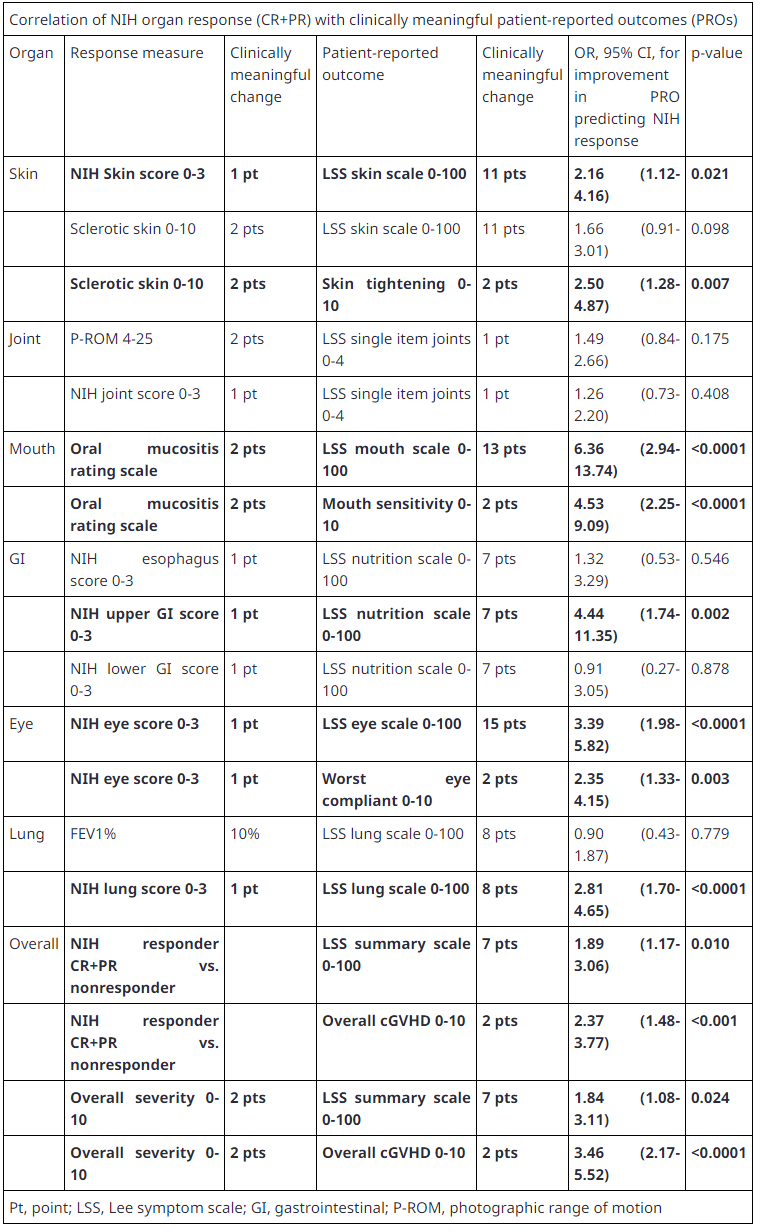
器官缓解定义为完全缓解(CR)和部分缓解(PR)。综上所述,器官缓解率为:皮肤35%(48/135),关节68%(84/124),口腔57%(56/99),眼睛41%(52/128),上消化道73%(19/26),下消化道87%(13/15),肺23%(14/61);总体缓解率为77%(130/170)。所有器官(关节、食道、下消化道除外)中至少有一个PRO美国国立卫生研究所和美国国立卫生研究所(NIH)器官缓解呈统计相关性,p
