在创新药开发过程中, 申办方如何与CDE进行沟通?
文丨药疯
创新药物的开发需要多学科的并肩作战,需要经验与创新的融合。在这个过程中,如果能得到药品评审中心评审老师的指导,无疑是及时的帮助。但是,无论是从公平公正的角度,还是从更好地促进药物研发创新的角度,都需要合理利用有限的评价资源。基于此,国家药品评审中心在几十年的工作中建立了适合当前的沟通模式;现在,根据自己的项目经验和政策研究,总结了申请人在药物开发过程中可以采取什么方式和CDE沟通,希望能让更多的从业者从中受益。
01
国内创新药评价-交流历史经验
20092000年,监管部门发布了《特殊审批品种沟通机制实施细则》,详细提出了特殊审批品种沟通程序、数据准备、沟通时限、会议纪要等要求。
20122000年,监管部门发布了《药品评审中心与注册申请人沟通会议管理规范(试行)》,定义了药品评审中心与申请人之间的沟通会议,明确了沟通会议的适用情况、程序和要求。
20132000年,监管部门发布了《国家食品药品监督管理局关于深化药品审批改革,进一步鼓励药品创新的意见》,建立了在线电子通信平台,建立了预约通信机制,确保新药研发机构及时与技术评价部门沟通,书面记录沟通结果。
20152000年,监管部门发布了《关于药品注册审批若干政策的通知》,指出在临床试验申请前和过程中加强评审人员与申请人的沟通,及时解决注册申请和临床试验过程中的问题。药品审计中心与申请人面对面沟通,形成会议纪要,列出议定事项。
20162000年,监管部门发布了《药物研发与技术评价沟通管理办法(试行)》。
20182000年,监管部门发布了《关于调整药物临床试验审批程序的通知》和《关于发布药物研发与技术沟通管理办法的通知》。
20202000年,监管部门发布了《药物研发与技术评价沟通管理办法》,作为沟通的主要政策文件。
图1.1 CDE发布《药物研发与技术评价沟通管理办法》
02
美国新药评价-沟通”模式
美国在评价过程中对创新药物的沟通方式可以从21 开始CFR IND部分sec.312.47体现在中间。2017年,FDA内部CDER和CBER药物研发联合发布IND申办者与FDA沟通的最佳实践指南详细介绍了沟通的概念、范围和建议的类型。
药物研发关键阶段会议主要包括IND前、I期临床结束(EOP1)、Ⅱ期临床结束(EOP2)和NDA前会议。
? IND前
重点关注内容:了解药物的作用机制、可能的研究设计期药物开发;特别是新药、新机制、计划505(b)(2)途径,以及具有特殊研发过程的药物等;当然,任何一种,IND申请人可以申请IND前会议。
? EOP1
关注内容:现有数据如何有利于现有数据Ⅱ临床对照试验设计的评价,讨论药物研发计划的相关内容;FDA特别鼓励治疗危及生命和严重虚弱性疾病的药物申请EOP1会议,特别是基于Ⅱ期临床试验批准能适合加速批准。
? EOP2
关注内容:现有数据如何说明药物是否足够安全,研究是否足够,如何充分指导Ⅲ期临床研发计划和设计的科学性;特别鼓励申请人申请新分子实体或上市药物的重大新用途EOP2会议;同样,任何申请人都可以申请EOP2会议。
? NDA前
关注内容:促进FDA评审人员了解计划上市申请的格式和内容,旨在揭示重大问题,确定药物安全性和有效性,讨论儿科试验和统计分析方法或结果,特别鼓励申请人为所有计划上市申请提出NDA之前的会议申请。
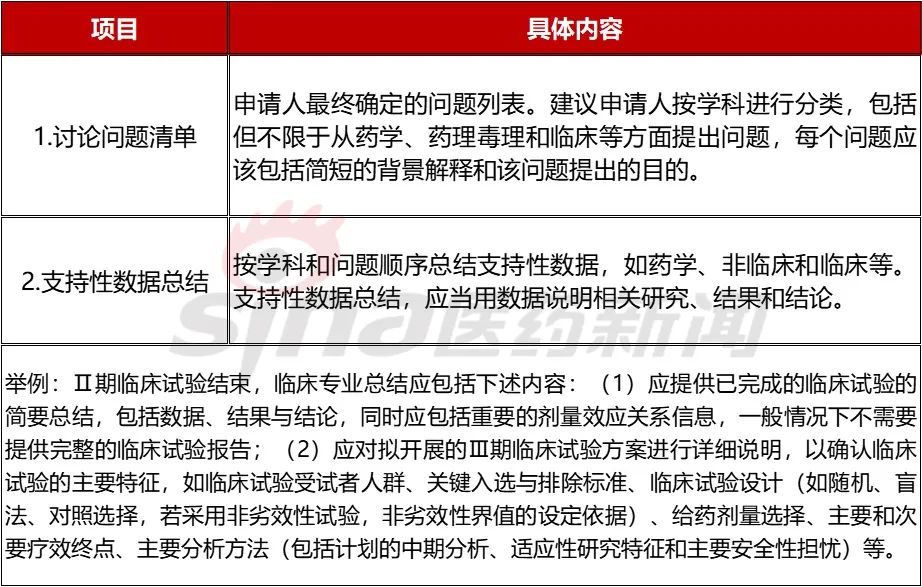
申办方向FDA寻求沟通可以基于以下几个方面:监管程序、临床统计、安全、临床药理药动、非临床药效-药代-毒理学、质量控制、儿科实验等。对于沟通会议,根据不同的内容、阶段和程度,可分为以下类别。详见下表。
表2.1 FDA沟通会议的类型和内容

03
《药物研发与技术评价沟通管理办法》重点
首先,《中华人民共和国药品管理法》和《药品登记管理办法》;会议沟通形式包括:面对面会议、视频会议、电话会议或书面回复,鼓励电话会议;会议类型分为I类、II类、III类别,详见下表,不难看出,大部分会议类型都集中在会议类型上,II类。PS:确定召开沟通会议的,I类会一般安排在申请后30天内召开,II类会一般安排在申请后60天内召开,III一般安排在申请后7575天内召开。
表3.1 沟通会议类型

会议前,根据管理办法,药品注册专员应与项目经理充分协商,确认时间、地点、议程等信息。药品审计中心参与者应在会议前对会议材料进行全面评价,并形成初步评价意见。
会议期间,交流会议通常由药品审计中心工作人员主持,根据事先确定的会议议程逐一讨论会议前提出的讨论问题。原则上,新的会议材料、发散性问题和临时增加的新问题不在沟通范围内。一般来说,沟通会议的时间是60-90分钟内。
会议结束后,会议纪要应按照沟通会议纪要模板的要求撰写。双方达成一致的,应当明确共同意见;双方不达成一致的,应当分别明确各自的意见。会议纪要最迟应在会议结束后30天内确定,并鼓励现场形成会议纪要。会议纪要由项目经理在定稿后2天内上传至沟通系统,申请人可通过申请人窗口查阅。PS:未经许可,申请人和其他参与者不得录音、录像、拍照。
表3.2 沟通会议信息
04
小结
综上所述,不难看出,我国多年来一直在探索药品研发交流会的流程、内容和方法,并借鉴了美国FDA许多现有的经验。但与此同时,政策也根据我国新药研发的当前国情进行了调整。对于申请人来说,在特定的研发时间点与评论员沟通有非常完整的程序。稍有不同的是,我国的沟通方式还没有进一步细化,系统还有很大的改进空间。
在实际操作过程中,根据以往的项目经验,发现申请人还需要探索与评论员沟通的节奏和方式,以提高沟通的及时性,特别是在有限的时间内使用电话沟通;此外,申请人的信息必须总结到位,尽可能支持沟通的需要,这是不同的IND申请材料内容!
但同时也要注意的是,关键数据一定不能刻意隐瞒,以免评论员根据不完整的数据做出错误的判断和建议。CDE给出明确的沟通路径,申请人必须充分利用,总结个性问题的共同解决方案,有利于更多项目的发展,形成申请人项目开发的硬实力!
参考资料:
1.https://www.cde.org.cn/main/news/viewInfoCommon/b823ed10d547b1427a6906c6739fdf89
2.FDA官网
https://www.fda.gov/
3.介绍和思考国内药品注册沟通制度.
https://www.cnki.net/
4.美国药品评价体系研究.
https://www.cnki.net/
5.CDE美国新药临床试验期间的沟通机制介绍与思考.
https://www.cnki.net/
6.《药物研发与技术评价沟通管理办法》.
https://www.cnki.net/
7.讨论药物研发与技术评价交流中常见统计专业问题.
https://www.cnki.net/
