从KRAS抑制剂到ADC NSCLC新药竞争加剧
文丨April Chen
在实体瘤新药开发中,NSCLC该领域一直是新药开发的必争之地,上市药物适应症人群的扩大和新靶点的探索,NSCLC治疗模式将迅速重塑。
01
第二个提交上市申请的KRAS抑制剂
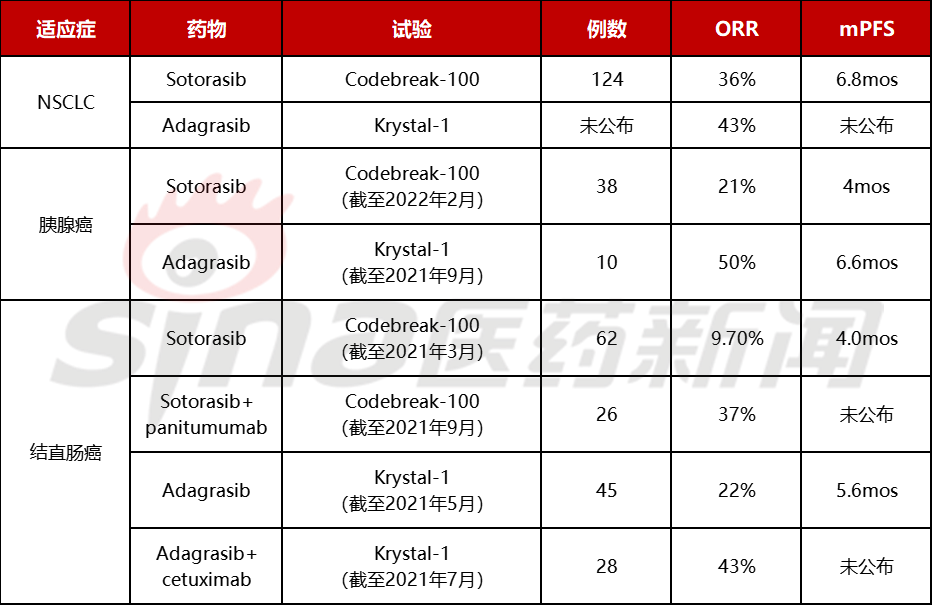
在安进的KRAS抑制剂Sotorasib获得有条件的批准G12C突变的NSCLC二线治疗后,另一个同期开发KRAS抑制剂,Mirati公司的adagrasib,2022年2月宣布提交治疗KRAS G12C上市申请突变肺癌二线治疗。FDA受理是基于二期KRYSTAL-1结果表明,该研究以前接受过免疫疗法和化疗、携带和携带KRASG12C晚期非小细胞肺癌患者突变。中位随访9个月,Adagrasib治疗的客观缓解率(ORR)疾病控制率为43%(DCR)为80%。
但这次Adagrasib评审周期为10个月,PDUFA日期为2022年12月14日,而不是之前预期的6个月加速评估,尽管之前已经被认定为突破性疗法。这不禁会和以前一样Sotorasib获得加速审批个月的加速审批进行比较,Sotorasib于2020年12月递交NDA,获得实时评价(RTOR),并于2021年5月获批。
Sotorasib确证研究 Codebreak-200 测试结果将于2022年底公布,并于2022年底公布。adagrasib PDUFA日期接近,不知是否FDA想等Codebreak-200比较结果。根据安进公布的2021年财报,2021年5月获批的 Sotorasib 半年销售额 9000万美元,下一步两个KRAS G12C抑制剂将在晚期 KRAS G12C 突变结直肠癌与胰腺癌竞争。
02
PD-(L)1抑制剂进入辅助和新辅助
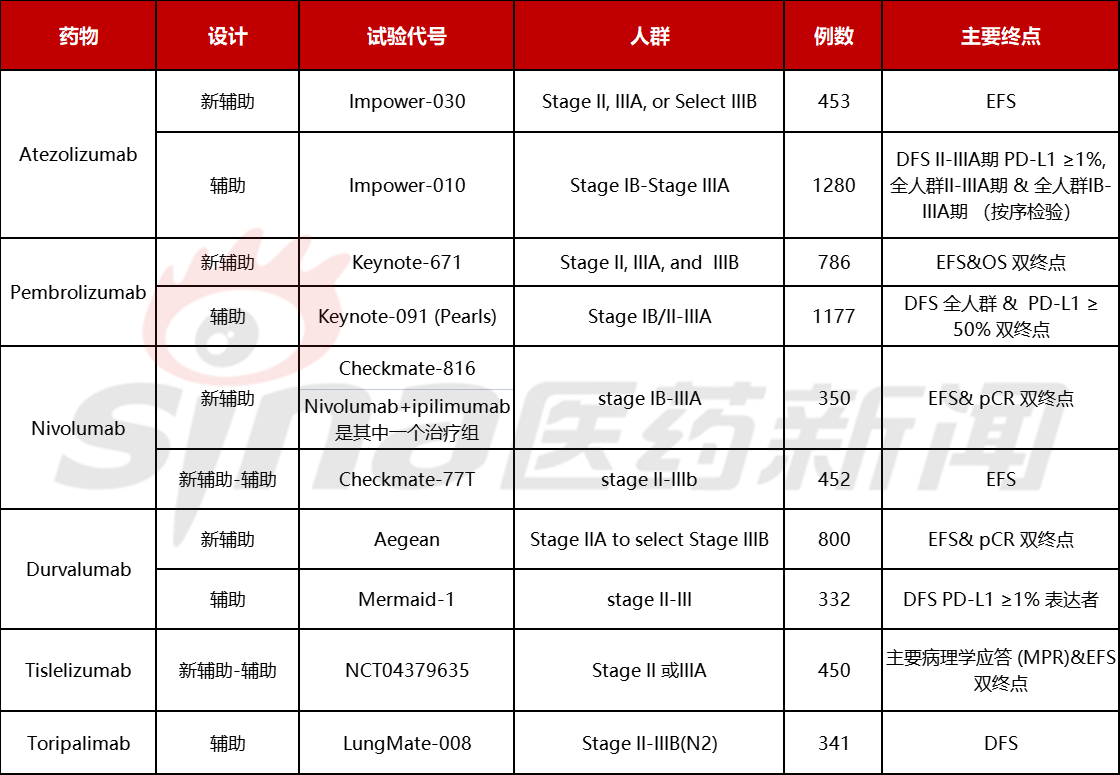
在NSCLC在辅助治疗中,2021年10月,Atezolizumab成为第一个上市的NSCLC 辅助PD-(L)1药物,给罗氏第一个占领蓝海市场辅助治疗的机会。批准是基于名称的批准。IMpower010试验包括1005例手术切除术和铂类化疗后II-IIIA 期 NSCLC 患者1:1随机使用Atezolizumab或对照组最佳支持性疗法(best supportive care)。结果表明,与对照组相比,Atezolizumab能显著降低 II-IIIA 期受试者 34% 癌症复发及死亡风险,PD-L1 ≥1% TC 的 II-IIIA 期非小细胞肺癌患者(n=476)。与 BSC 组的 35.3 个月(相比,atezolizumab 组患者未达到中位 DFS(HR 0.66;p =0.004)。对 PD-L1 TC ≥ 50%和PD-L1 TC 1-49%的II-IIIA 期 NSCLC 患者亚组分析,DFS HR 分别为 0.43和 0.87。
下一个进展最快的是Pembrolizumab,与Atezolizumab区别在于,一是增加了IB期NSCLC受试者;第二,联合辅助含铂化疗不是必须的选择,而是作为分层因素之一;第三,主要终点包括PD-L1表达的全人群和PD-L1高表达(TPS ≥50%)人群的DFS。如果能获得批准,使用者将使用更多。2022年1月MSD根据宣布期间的分析结果,无论 PD-L1 表达水平,Pembrolizumab相对安慰剂显著改善DFS。对于PD-L1高表达人群(TPS≥50%)DFS在统计统计意义上的显著差异,试验将继续分析PD-L1高表达人群DFS和OS。
Durvalumab辅助疗法的设计与Atezolizumab类似,而Nivolumab的Checkmate-77T实验包括辅助和新辅助。
在NSCLC在新的辅助治疗中Nivolumab成为第一批PD-1药物于2022年3月4日获得,FDA批准用于作为NSCLC新辅助疗法的批准是基于新辅助疗法Checkmate-816 研究实现了无事件生存期和病理完全反应的双重终点,可实现无事件生存期和病理完全反应EFS终点是关键。
03
ADC选择新的靶向药物药物
ADC开始在晚期NSCLC 治疗开始显示靶向驱动基因突变的前景NSCLC提供了除TKI更多的治疗选择,第一三共三款ADC药物在NSCLC都取得了突破。
Datopotamab deruxtecan是靶向TROP2 的 ADC,在名为TROPION-PanTumor01 I 期试验结果显示,大多数患者以前接受过三种或三种以上的治疗包括铂化疗(94%)或免疫疗法(84%)。

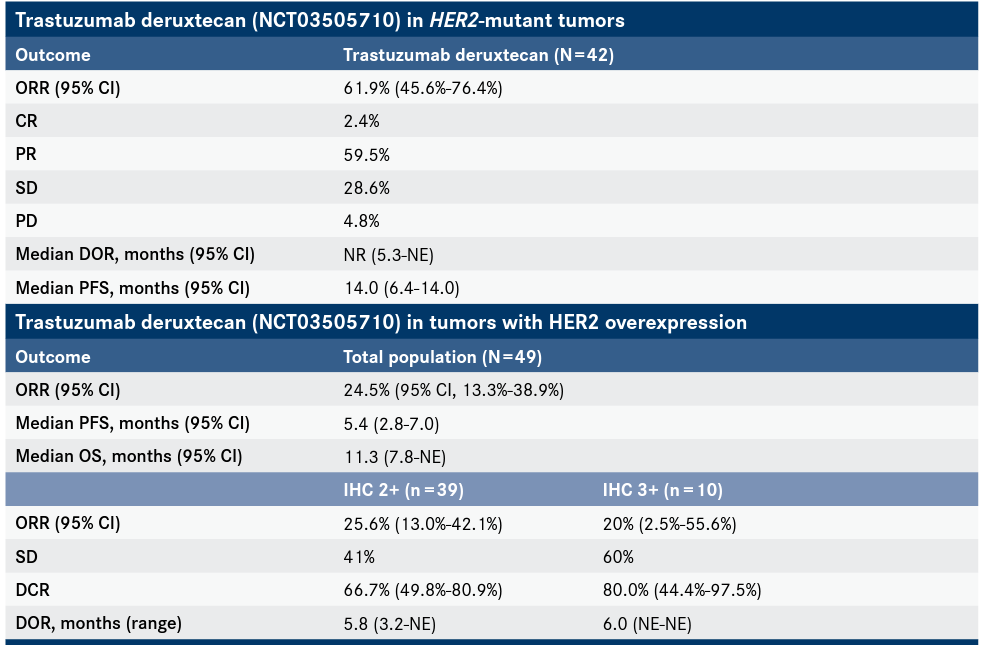
Trastuzumab deruxtecan是靶向HER2的ADC,之前已获批用于HER2阳性乳腺癌,在名称上DESTINY-Lung01 II 期试验的中期分析表明,在 期试验中,HER2虽然突变或高表达的人都表现出疗效,但在HER2突变人群表明收益较高。
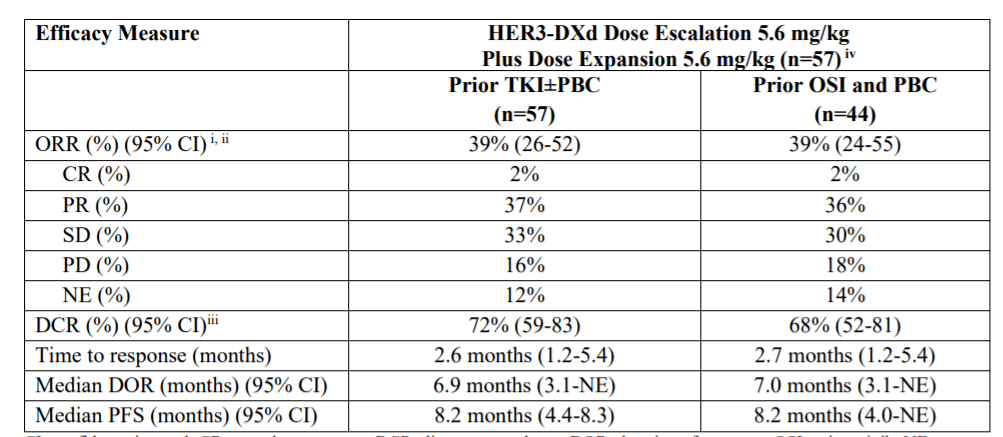
Patritumab deruxtecan是靶向HER3的ADC,根据公布的早期临床试验结果,57人接受patritumab deruxtecan(5.6 mg/kg)治疗的入组患者中,ORR中位随访时间为39%10.2一个月内,中位无进展生存期(PFS)为8.2本研究的数据是本月启动的关键性Herthena-Lung01支持实验设计。