Krystal Biotech向FDA递交B-VEC申请生物制品许可
发布时间: 2022-06-23 10:36:58
今日,Krystal Biotech已向美国宣布FDA提交其在研基因疗法B-VEC(beremagene geperpavec)申请生物制品许可(BLA),用于治疗营养不良的大疱性表皮松解症(DEB)患者。B-VEC是现货型(off-the-shelf),外部基因治疗旨在为患者的皮肤细胞提供两种治疗方法COL7A正常复制基因,生成功能VII型胶原蛋白(COL7)治疗蛋白疾病的基本机制蛋白。
DEB它是一种罕见而严重的单基因慢性遗传疾病,通过编码COL7的COL7A1.基因突变导致皮肤缺乏胶原蛋白,导致表皮和真皮分离。患者的皮肤和粘膜组织极其脆弱。轻微的摩擦或创伤会导致水泡和撕裂。开放性伤口会导致皮肤感染和纤维化,这可能会融合手指和脚趾,最终增加鳞状细胞癌的风险。在严重的情况下,它可能是致命的。目前还没有批准的治疗方法。
B-VEC旨在为患者的皮肤细胞提供正常的制造COL在分子水平上治疗蛋白质模板DEB。它利用基因工程改造HSV-1病毒载体,两个功能正常的载体COL7A1.基因拷贝直接传递到患者的皮肤细胞。这种非侵袭性的外部基因疗法可以反复给药。FDA这种药物已经授予治疗DEB孤儿药资格和再生医学先进疗法(RMAT)认定。
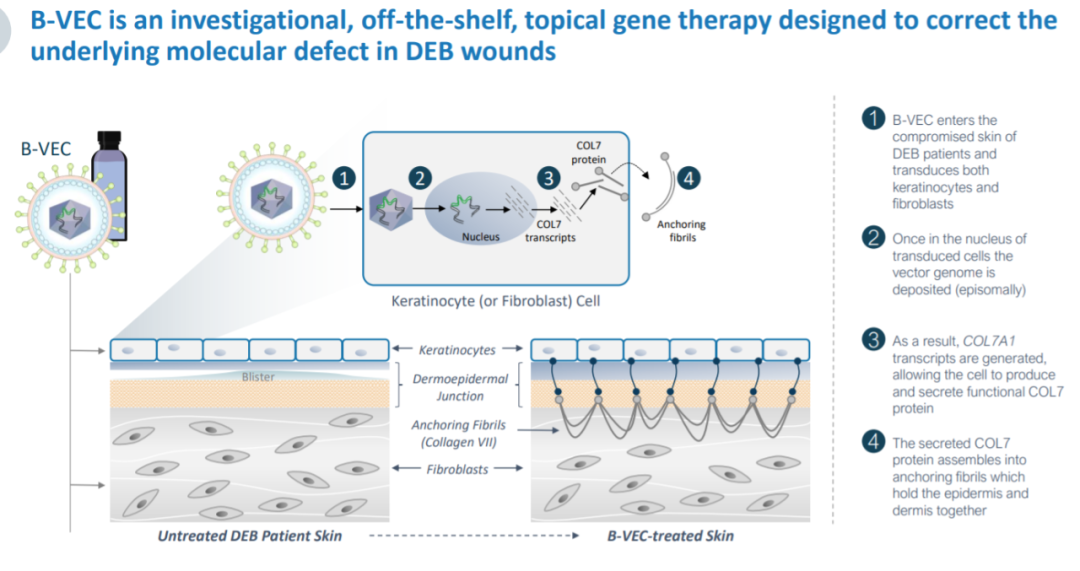
B-VEC(图片来源:Krystal Biotech公司官网)
这一BLA获得两个含有安慰剂的临床试验GEM-3和GEM-1/2支持。GEM-3.临床试验达到其主要目的地,31例DEB患者中:
与安慰剂相比,治疗6个月时,接受67%(22%)B-VEC病人的伤口完全愈合(p
