RNAi创新崛起:Alnylam报告Cemdisiran治疗IgA二期临床阳性肾病结果
2022年6月9日,Alnylam Pharmaceuticals(简称“Alnylam”)公布了Cemdisiran成人免疫球蛋白A肾病(IgAN)患者II临床试验结果。试验结果达到主要目的地,蛋白肌酐比平均下降37%,次要终点结果达到治疗指标,无药物相关不良反应。Alnylam成立于2002年,是一家以研发为基础的公司RNA或RNAi干涉是一种新的治疗方法,属于生物制药公司RNAi龙头企业在治疗领域,Cemdisiran预计它将成为第一个补体目标RNAi药物。

二期试验是一项多中心的随机、双盲和安慰剂对照研究,旨在评估评估Cemdisiran成人免疫球蛋白A肾病(IgAN)患者的疗效和安全性。原发性临床诊断IgA31名成年患者(≥18岁且≤随机分组65岁)Cemdisiran该组和安慰剂组的受试者人数比例为 2:1。这项研究分为三个阶段。第一阶段是 14周导入期,在此期间,血压、肾功能、血尿程度、蛋白质和基本药物的监测保持不变。在此期间,患者没有接受研究药物(Cemdisiran或安慰剂)。第二阶段是 32 周的治疗期,在此期间,患者每4周服用 600 mg Cemdisiran或安慰剂,以及基本药物(血管紧张素转化酶(ACE) 抑制剂或血管紧张素。II 受体阻滞剂(ARB))联合使用。第三阶段是为期52周的开放标签扩展(OLE)进一步评估Cemdisiran长期安全和临床活动。OLE在此期间,所有患者(包括最初使用安慰剂的患者)都被接受Cemdisiran联合基本药物治疗。这项研究的主要目的是32个周时,24个周时,尿蛋白和肌酐的比例从基线的百分比变化。次要目的是额外测量蛋白尿,改变血尿,一些临床缓解患者的百分比和不良事件的频率。所有患者(包括最初使用安慰剂的患者)都被接受Cemdisiran联合基本用药标准治疗。
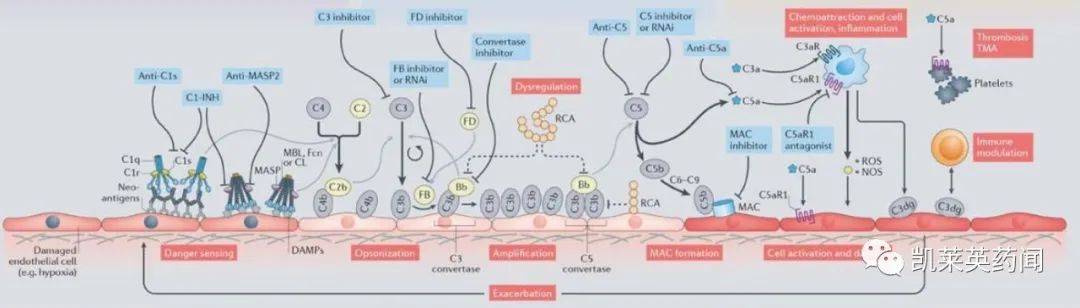
Cemdisiran是RNAi针对补体途径的末端补体成分 5(C5),与 N-乙酰半乳糖胺(GalNAc) 可用于治疗补体介导的疾病。皮下给药cemdisiran 后,GalNAc 唾液酸糖蛋白受体在配体部分和肝细胞上表达(ASGPR)特异性结合并被其吸收。在细胞中,siRNA 与 C5 mRNA结合,从而抑制 C5 蛋白质的翻译和表达,补充系统作为宿主防御的保护机制,在免疫中起着核心作用,但其失衡会导致各种危及生命的人类疾病的并发症,包括阵发性睡眠血红蛋白尿(PNH)、非典型溶血性尿毒症综合征(aHUS)、重症肌无力、视神经脊髓炎和膜性肾病。
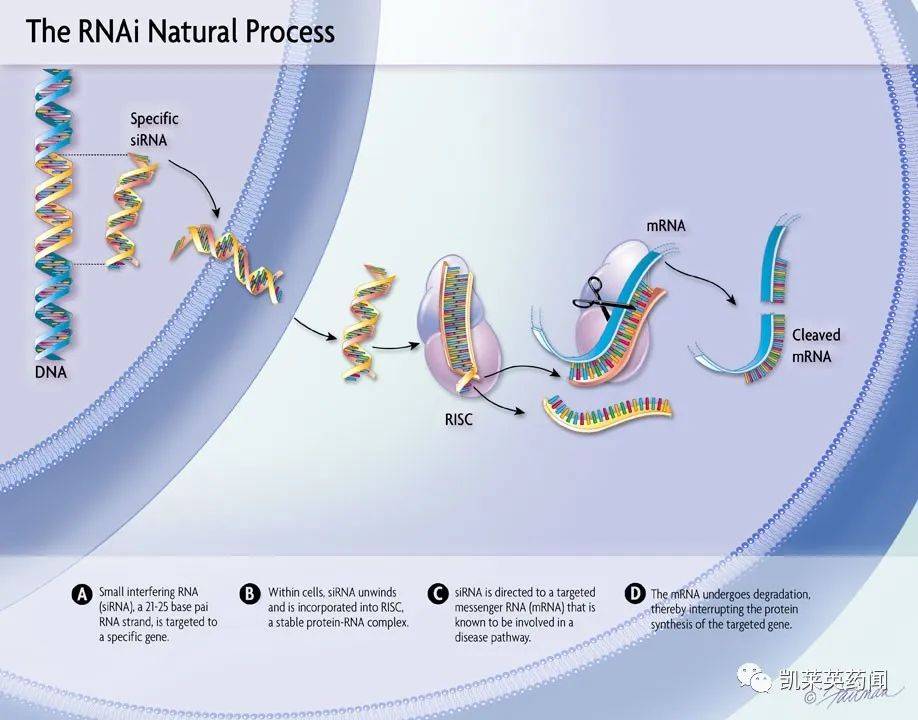
RNAi 药物属于小核酸药物,其作用机制是长双链RNA被剪成短双链RNA之后,与蛋白质结合形成siRNA诱导干扰复合体(RISC),短链RNA正义链降解后,RISC 再与特定mRNA 结合,使mRNA降解,最后表达相应基因的沉默。目前已知有RNAi作用的RNA主要包括:siRNA、miRNA 和 piRNA等。

目前,全球已上市4款RNAi药物,均由Alnylam开发,2021年销量超过40%.5亿美元。
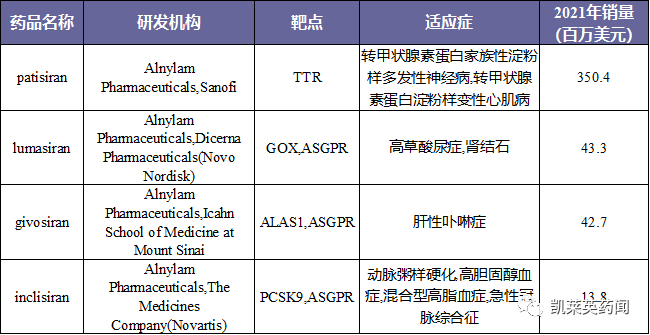
以下是世界上主要的临床研究RNAi药物:
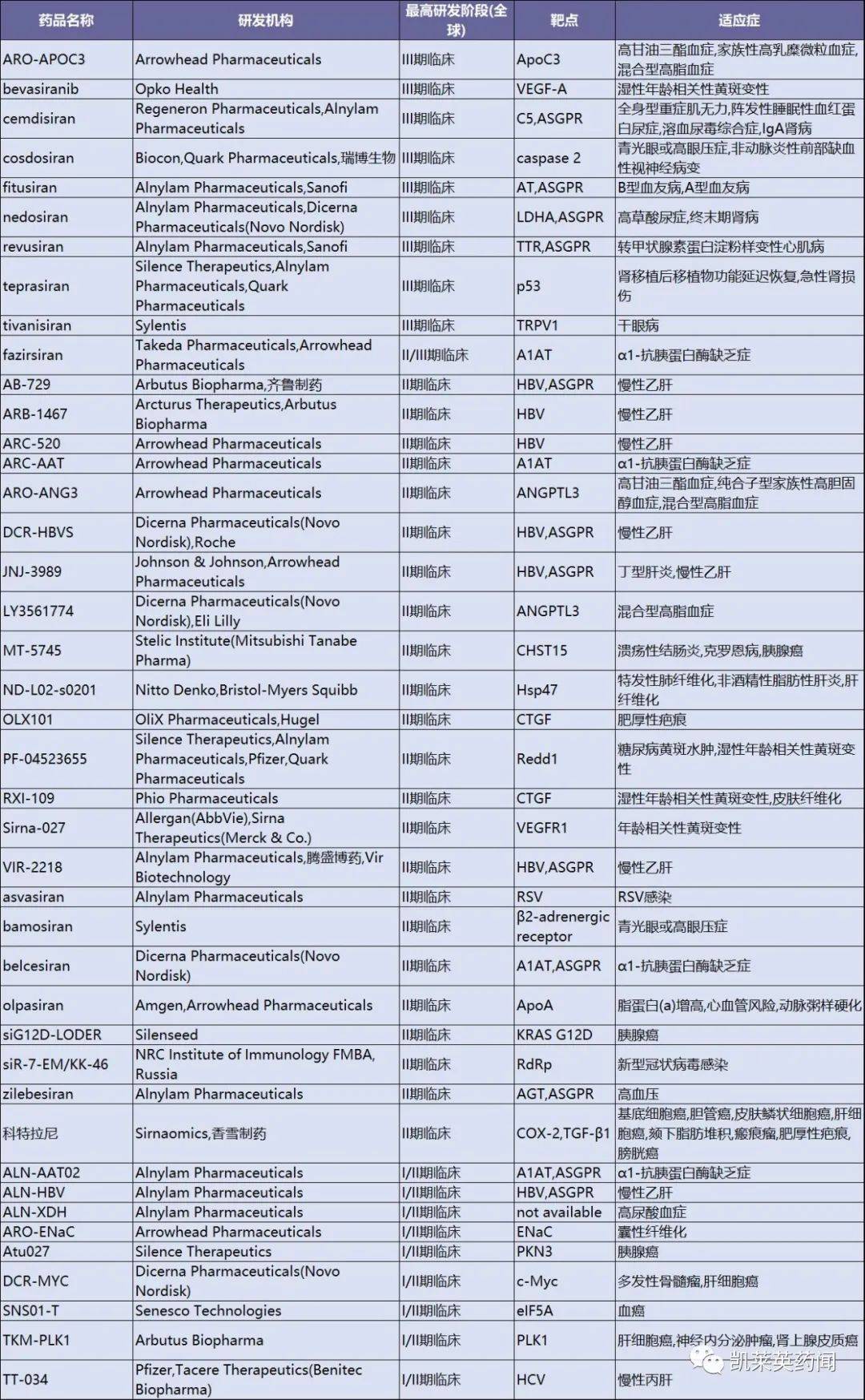
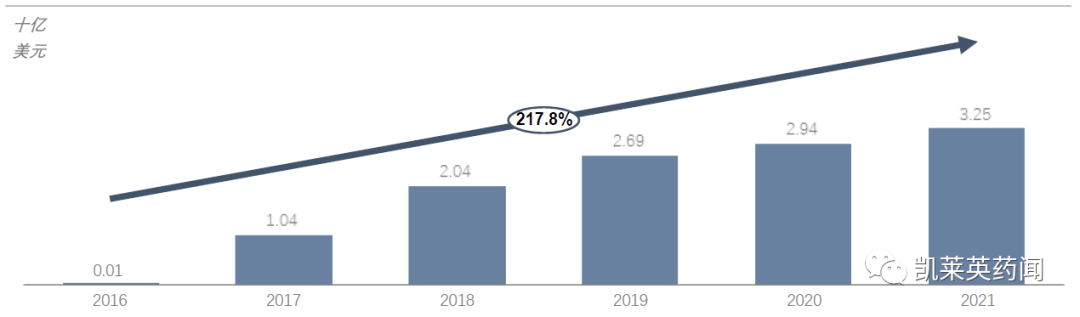
以RNAi和ASO以小核酸为代表的药物在商业上取得了一定的成功。根据弗罗斯特·沙利文的数据,小核酸药物的全球市场规模从2016年开始.1亿美元增长到2021.5亿美元,年复合增长率高达217.8%。未来,随着小核酸药物在临床阶段的不断上市,特别是针对患者群体较大的适应症药物,将进一步推动市场的快速发展。