AI辅助开发 获得老药新用FDA批准
今日,BioXcel Therapeutics公司宣布,美国FDA已批准Igalmi(右美托咪定)舌下膜剂上市,用于急性治疗和精神分裂症或精神分裂症I/II与双相情感障碍相关的激越(agitation)。新闻稿指出,这是FDA首款口溶舌下膜剂被批准用于治疗轻度、中度或重度激越。BioXcel Therapeutics致力于基于人工智能(AI)利用经批准或临床验证的候选疗法,探索神经疾病和免疫肿瘤学领域的新疗法。
高达25%的精神分裂症和双相情感障碍患者会经历激越,每年激越发作可达10~17第二,给患者、护理人员和医疗卫生系统带来沉重负担。
Igalmi是一种选择性α2右美托咪定舌下膜剂,肾上腺素受体激动剂,通过口腔吸收迅速生效。它的发现源于它的发现。BioXcel的AI技术平台可以根据指定的适应症设置搜索条件,从数百万篇科学论文中搜索可能与治疗这种适应症相关的潜在疗法。该平台发现,右美托咪定具有治疗激越的所有特征。BioXcel基于这种化合物启动Igalmi开发。由于右美托咪定已获批上市,具有已知的安全特点,这使得右美托咪定具有已知的安全特点。BioXcel它能大大加快其临床发展速度。Igalmi新药申请的第一次临床试验(NDA)提交不到三年。
FDA批准是基于两个关键的随机双盲,包括安慰剂对比的三期临床试验结果。在这两个试验中,Igalmi两种不同剂量在第一次治疗两小时后达到试验的主要终点。与基线相比,改进评价激增PEC评分。Igalmi同时达到关键次要终点,表现出快速生效的特点。接受治疗时。20~30与安慰剂相比,分钟后的统计数据显著不同。
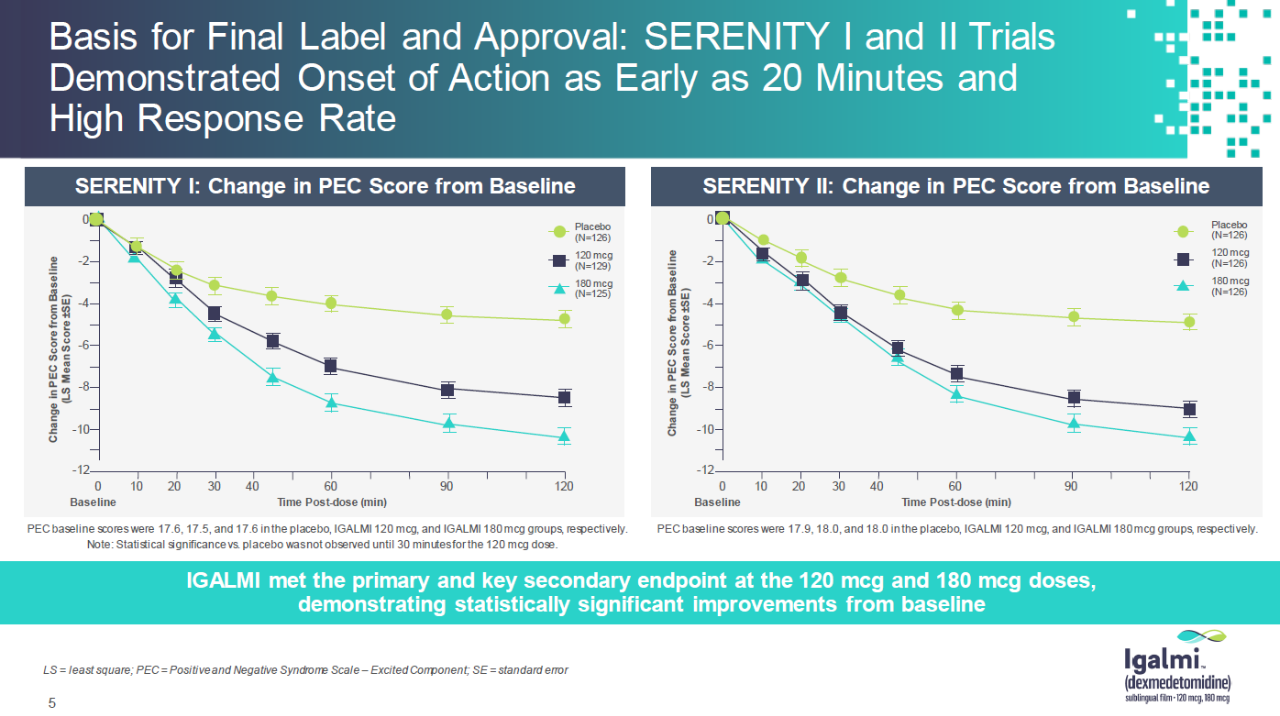
▲Igalmi三期临床试验结果(图片来源:BioXcel公司官网)
“Igalmi是近10年来首次治疗精神分裂症或I/II与双相情感障碍相关的新型急性疗法代表了帮助患者控制这种症状的差异化模式。BioXcel公司首席执行官Vimal Mehta博士说:这个里程碑意味着我们利用它AI开发神经病变革性疗法的目标是平台的一大步。
参考资料:
[1] BioXcel Therapeutics Announces FDA Approval of IGALMI? (dexmedetomidine) Sublingual Film for Acute Treatment of Agitation Associated with Schizophrenia or Bipolar I or II Disorder in Adults. Retrieved April 6,2022,from https://www.globenewswire.com/news-release/2022/04/06/24172/en/BioXcel-Therapeutics-Announces-FDA-Approval-of-IGALMI-dexmedetomidine-Sublingual-Film-for-Acute-Treatment-of-Agitation-Associated-with-Schizophrenia-or-Bipolar-I-or-II-Disorder-in-.html
[2] A Win for AI: FDA Approves BioXCel Therapy for Bipolar Disorder and Schizophrenia. Retrieved April 6,2022,from https://www.biospace.com/article/a-win-for-ai-fda-approves-bioxcel-s-treatment-for-bipolar-and-schizophrenia/
