FDA批准首款LAG-3抗体疗法上市
3月18日,百时美施贵宝(BMS)宣布,FDA批准Opdualag(relatlimab nivolumab,LAG-3 PD-1)固定剂量复方组合的上市申请用于治疗成人和12岁以上青少年(体重)≥40kg)不可手术切除或转移性黑色素瘤。
值得一提的是,relatlimab是美国FDA批准的首款LAG-3抗体也是近10年来获批的第一种创新的癌症免疫疗法。relatlimab是继CTLA-4、PD-1/PD-L1之后,全球批准的第三类免疫检查点抑制剂。BMS也是第一家同时上市三种不同免疫检查点抑制剂的公司。
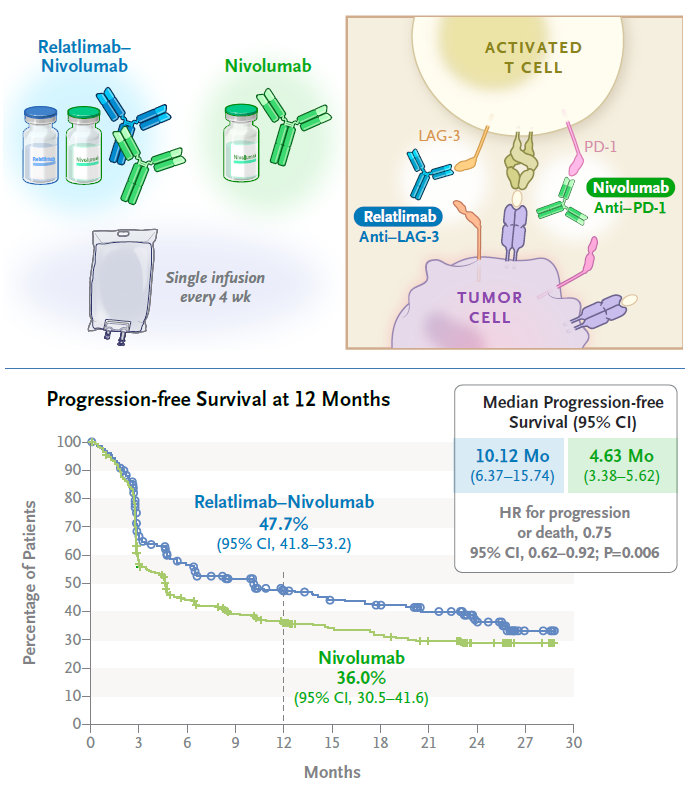
淋巴细胞激活基因-3(LAG-3)和程序性死亡受体-1(PD-1)它是两种不同的抑制性免疫检查点,通常表达在肿瘤浸润淋巴细胞中(TILs),并导致肿瘤介导T细胞衰竭LAG-3阻断抗体relatlimab和PD-1抑制剂nivolumab可激活联合治疗T细胞,从而引起改善的免疫反应,促进肿瘤细胞的死亡。FDA本批准主要基于II/III期RELATIVITY-047临床试验数据。1月6日,该研究的详细结果在《新英格兰医学杂志》上公布。
数据显示,对于过去未经治疗的转移性或不可切除的黑色素瘤患者,relatlimab nivolumab与一线疗法相比,固定剂量复方作为一线疗法Opdivo单药治疗实现了具有统计学和临床意义的无进展生存期(PFS)获益(10.12 vs 4.63个月,HR=0.75; 95% CI: 0.62-0.92,p=0.0055)。这是转移性黑色素瘤中第一个更抗性PD-1抗体单药治疗显示出统计优势。
亚组分析显示,relatlimab nivolumab组LAG-3表达阳性(≥1%)中位患者PFS为12.58个月,而LAG-3表达<1患者中位%PFS仅为4.83个月。
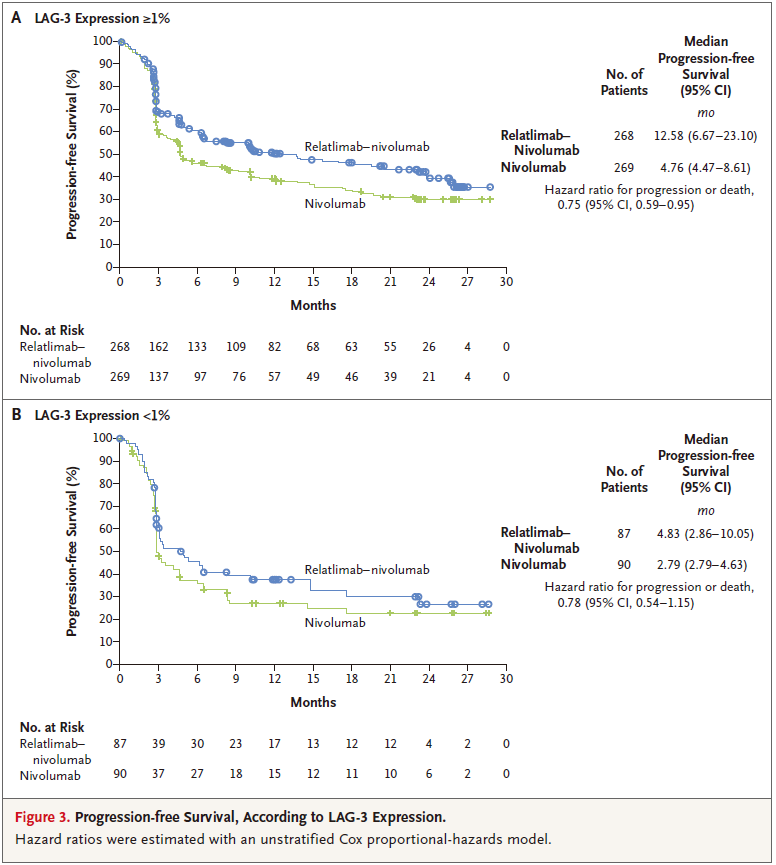
RELATIVITY-047研究中根据LAG-3表达水平PFS亚组分析
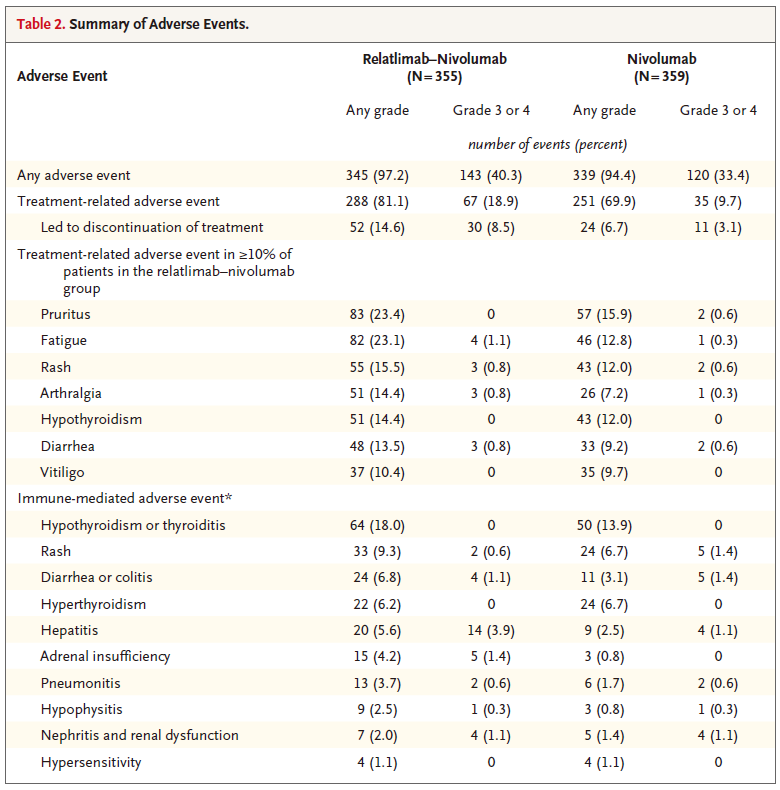
安全方面,三、四级治疗相关不良事件(TRAE)更常见于联合治疗组,relatlimab nivolumab治疗组的发病率为 18.9%,而NIVO单药组的发生率为 9.7%。
参考资料来源:药明康德、医药魔方
