全球医药卫生产业政策措施有哪些特点?
文丨陈凯
近年来,围绕生物技术制高点的占领和医药卫生产业发展新动力的培育,各国出台了加快医疗生物技术创新突破的政策措施。同时,欧美国家继续加强与中国生物技术的战略竞争,重视医疗卫生领域的供应链保障。在医药卫生产业全球化发展趋势下,各国继续加强监管合作,确保药品供应,促进产业创新发展。
01
世界主要经济体推动医疗生物技术创新突破
美国创新组织模式,探索建立国家研究平台,加强国家战略科技实力,解决医学研究创新运行机制瓶颈
2021年4月,拜登政府提议成立高级健康研究计划局 (ARPA-H)。该部门依托美国国立卫生研究院(NIH)申请预算为65亿美元,以美国国防部高级研究计划局为基础(DARPA)作为模型,通过资助高风险创新项目,加快医疗技术的发展,特别注重癌症、糖尿病和老年痴呆症的防治,追求其他能够重塑健康研究的变革创新。从现有的补贴机制来看,NIH商业化部门要求在合理的时间内获得预期的投资回报,以吸引投资者。一些最有潜力的创新想法可能永远不会成熟。ARPA-H建立仍存在争议,但探索组织模式和项目补贴机制,为创新理念提供理想平台,重点投资医疗卫生领域的突破性技术和广泛应用的平台、资源和解决方案,造福所有患者。这些投资活动通常不能通过传统的基础研究和商业活动轻易实现。
2021年6月,美国科技智库信息技术与创新基金会发布了《确保美国生物制药持续竞争力》报告。建议为确保美国生物制药领域的全球领先地位,应制定强有力的国家生物制药竞争力战略,投入更多关注生物医学创新的产业-大学伙伴关系,NIH每年增加至少120亿美元的资金,达到500亿美元。
许多国家出台了新的战略规划,不断修订和完善中长期战略部署
2019年6月,日本发布了《2019年综合创新战略》,并在附件中正式推出了《2019年生物战略》,在《生物技术战略大纲》(2002年)和《促进生物技术创新根本性强化措施》(2008年)战略之后,再次确认了生物技术的战略地位。该战略整合了医疗和非医疗领域,重点发展高性能生物材料、生物塑料、生物药物、生物制造系统等领域,并提供重点资金。同时,在生物资源库、生物数据技术设施、生物技术人才等方面也提出了重要措施。
俄罗斯发布《2019-2027俄罗斯联邦基因技术发展计划的主要目标是加快基因编辑技术等基因技术的发展,为医疗、农业和工业创造科技储备,监测和防止生物紧急情况的发生。韩国发布了《生物健康产业创新战略》,以促进创新药物、医疗器械和医疗技术的发展,促进生物健康产业的出口增长。英国发布了《2019年生物技术领域实施计划》,以发展尖端生物技术,应对战略挑战,为技术发展奠定坚实的基础。2021年,法国发布了《2030年法国医疗卫生创新战略》,重点宣布建立大型科研集群,计划使用超过40亿欧元的公共资金进行科研,旨在将法国重建成为医疗卫生领域的创新国家。
02
更加重视国内供应链保障
新冠肺炎爆发后,世界各国对生物医学的需求不断扩大,药品和医疗用品短缺。政府积极采取措施确保供应链稳定。
欧盟计划更新立法,加强政策激励和惩戒措施,确保药品供应
在新冠肺炎疫情初期,欧盟在从中国和印度获得药物和药物成分方面遇到了困难。欧洲委员会估计,世界上三分之二的原料药是在印度和中国生产的。
为了解决制造商过少、供应链脆弱、财政激励措施不足等原因造成的药品短缺问题,欧盟正在考虑制定更严格的药品供应规定,以确保药品供应。2020年11月,欧洲药品战略发布,包括加强危机预防和应对机制,确保供应链多样化和安全,解决药品短缺问题,欧盟委员会寻求制药商和监管机构之间的更多对话,提出解决全球供应链脆弱性的建议。欧盟计划要求制药公司从研发奖励和企业罚款方面制定应急计划,并接受更严格的供应义务。欧盟卫生专员 Stella Kyriakides 在斯洛文尼亚举行的卫生部长会议上说:我们需要更新立法,以弥补统一报告、供应义务和供应链透明度的不足。欧洲委员会计划于2022年12月提出立法建议。
美国计划改善中国API制造能力
由FDA和ASPR牵头的白宫报告指出,美国的药品供应链越来越依赖国外制造的药品和活性药物成分(API)以及关键的起始材料。同时,报告建议促进美国当地的生产和国际合作,促进创新制造技术的建立和生产技术的研发。
美国白宫,美国卫生和公共服务部(HHS)、美国食品药品监督管理局(FDA)2021年6月,发布了确保美国药品供应链安全的政策建议,HHS开发初步承诺提供近6000万美元,旨在提高国内水平API为了减少对全球药品供应链的依赖,制造能力的新平台技术。
各国支持原料药生产迁回本土
新冠疫情凸显了原料为王的重要性。许多国家计划通过将原料药生产迁回当地,恢复完整的产业链,摆脱对其他国家原料药进口的依赖。
美国、欧洲、日本、印度和其他国家都宣布实现关键药物和医疗产品的本地生产。例如,法国赛诺菲将其在欧洲的六种原料药放在欧洲(API)合并生产基地,建立独立的生产基地API为了平衡欧洲对亚洲原料药的依赖,日本将于2022年在岩手县开始生产抗生素原料;印度联邦内阁批准了13亿美元的刺激计划,重点支持生产53种原料药和关键中间体,投资在印度设立3个原料药园区。
03
欧美国家压制中国在生物技术领域的赶超
为了保持其在技术和科学方面的领先地位,美国系统地加强了对生物技术的支持和保护,并继续加强对中国生物技术的抑制
美国正在以立法的形式全面升级与中国前沿技术的竞争。2021年6月,美国参议院通过了《2021年美国创新与竞争法案》,通过立法开启了系统制华时代。《2021年中国挑战法案》是六个部分之一。该法案将生物技术、医疗技术、基因组学和合成生物学列为十大关键技术领域之一,并提出重点保护生物医学研究领域,特别是人类基因信息。
在过去的三年里,美国加强了对中国的压力,并保持了其在生物技术领域的领先地位。限制中国在美国生物技术研发投资,对300多种生物医学产品征收关税,禁止向中国出口生物技术,将生物技术龙头企业列入实体清单,取消中国新冠检测试剂的紧急使用授权。
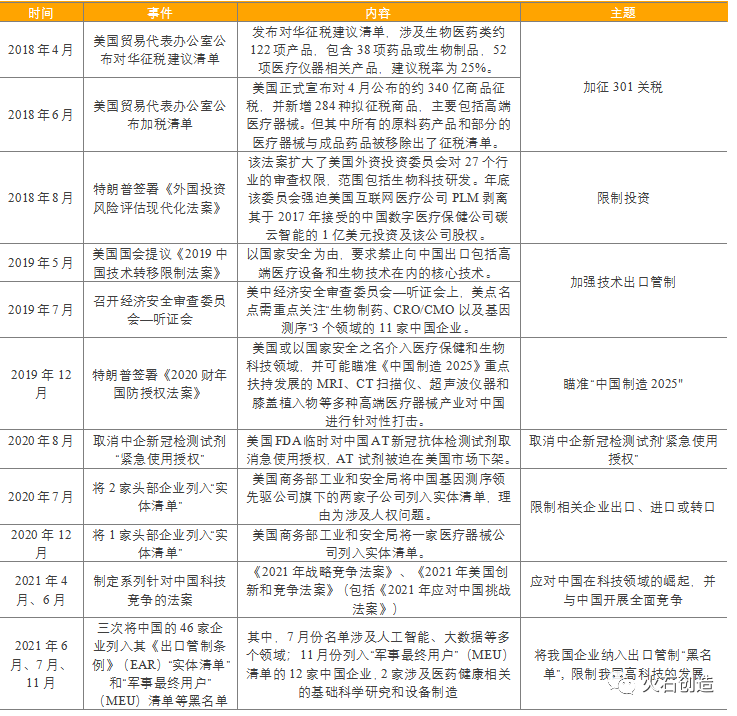
欧盟也在防止中国在生物技术等特殊领域投资欧洲
2020年3月,欧盟委员会发布了保护欧洲重要资产和技术的指导纲要,将健康、医学研究、生物技术等战略产业纳入外资审查范围。今年6月,欧盟委员会发布了防止不公平竞争的白皮书,就加强对欧盟以外第三国政府补贴企业行为的监管征求公众意见,进一步提高中国企业对欧洲的投资门槛。与此同时,美国通过与欧盟等国家和组织建立更加多样化的联盟关系,利用彼此的优势,共同遏制中国的发展,防止中国超越美国,2021年12月,美国执行副国务卿舍曼、欧盟对外行动秘书长桑尼诺在华盛顿主持了第二次会议,并发表声明,实现供应链多样化,以解决中国的经济胁迫。
04
监督审批合作促进产业创新发展
生物医学基础研究、产品开发、市场流通和并购仍将在全球范围内进行,药品供应链保障、研发和监管专业知识与多方合作密不可分。主流国家的监管体系将趋同,特别是在临床试验、现场验证和药物预警领域,信息共享和交流将更加普遍。
美国和欧盟药品监督管理部门加强产品开发信息共享,FDA 和 EMA 启动复杂仿制药-并行科学建议混合产品试点计划
美国 FDA 和欧洲药品管理局(EMA)2021年9月宣布启动试点计划,为 FDA 复杂仿制药产品简化新药申请(ANDA)和 EMA 混合产品上市许可申请(MAA)申请人提供并行科学建议(PSA),试点项目是 FDA 和 EMA 现有新药和生物制品PSA 的扩展。PSA试点计划的目标是 FDA 和 EMA 评审人员提供优化申请人全球产品开发计划的机制,在复杂仿制药/混合产品开发阶段与申请人同时就科学问题交换意见,让申请人更深入地了解两个机构的监管决策基础,帮助申请人避免不必要的重复或多样化的检测方法,缩短审批时间。
加强制药领域的反垄断合作,确保药品供应,促进创新
20212003年3月,针对日益增长的制药并购交易,欧盟委员会表示成立了专门的工作组,将与美国、英国同行合作,分享如何审查制药行业并购的专业知识,更严格地审查并购,防止并购推高药品价格,阻碍创新。工作组将总结近年来并购的经验教训,探索和促进行业的竞争和创新。
近年来,欧美反垄断监管机构逐步加强对制药并购等可能危害消费者和竞争的做法的审查,这通常是反向支付协议和药品生命期专利策略的焦点。
国际中国加强药品监管国际化进程,与多国合作
我国监管国际化进程逐步加快。国家食品药品监督管理局与多个地区药品监督管理部门签署了合作谅解备忘录,促进药品监督国际交流活动,深化药品、医疗器械、化妆品监督领域的合作。
2021今年9月,由国家食品药品监督管理局和商务部联合主办的一带一路国家药品监督发展合作研讨会暨一带一路国家药品监督管理合作与产业发展研讨会开幕式在北京举行。来自17个国家的卫生药品监督管理机构的官员和专家出席了研讨会。
20212009年9月,由国家食品药品监督管理局和广西壮族自治区人民政府联合主办的第六届中国-东盟药品合作发展峰会论坛在广西防城港开幕。本次论坛以加强药品医疗器械监管,创造产业精工智能制造发展为主题,代表就药品监管法制建设、深化审批制度改革、抗击新冠肺炎疫情等方面进行了深入交流和探讨。
20212018年6月,中英药品监督合作项目启动会以视频形式召开,通过了2021年中英药品监督合作项目计划,计划在药品评价、检查、上市后监测等领域开展技术交流活动,进一步增进了解,深化合作。2018年1月,中英药品监督管理机构签署了《药品与医疗器械合作谅解备忘录》。
20212004年4月,中国国家药品监督管理局与日本药品监督管理机构召开双边会议,就中日双边监督合作进行深入交流。中日监管机构就《药品管理法》修订、临床试验管理、现实世界数据应用、药品上市后监管等热点问题进行了主题报告,并在2020中日药品健康交流会上进行了热烈讨论。
受新冠肺炎疫情影响,国家将更加重视公共卫生领域的科技发展,生命健康领域将成为全球科技创新的关键核心领域,国家将进一步加强相关基础研究,提高医疗卫生关键核心技术能力,增加疾病防治和公共卫生战略技术储备,生命健康技术战略竞争将进一步加剧,但同时国家将进一步加强监管合作,服务于医疗卫生产业的全球合作。
