新冠口服药致畸?盐野义反应
据日本《东京新闻》4月13日报道,从相关人士处获悉,日本盐野义制药新冠口服药S-217622动物实验表明,该药物可能导致胎儿骨骼发育异常,并有致畸的可能性。盐野义不建议孕妇服用这种药物。

受此消息影响,盐野义股票13日暴跌近16%,是2011年3月以来最大的盘中跌幅。市值也一度从2.31万亿日元,跌至1.952万亿日元,蒸发近3600亿日元,相当于180亿元左右。
低剂量组病毒载量下降100%
盐野义的新冠药S-217622它是由北海道大学和盐野义共同开发的,是由北海道大学和盐野义共同开发的3CL蛋白酶抑制剂。与辉瑞的新冠药。Paxlovid原理类似,S-217622通过抑制3CL蛋白酶的活性使蛋白质前体无法裂解和形成成熟的病毒体,抑制病毒的自我复制。S-217622通过结构改进,可以摆脱对P450依靠酶抑制剂(如利托那韦),单药治疗新冠,将扩大适用范围。
今年2月7日和2月25日,盐野义先后公布Ⅱ/Ⅲ期临床试验Ⅱa和Ⅱb试验结果Ⅱa根据数据,与安慰剂相比,S-217622可显著降低病毒滴度RNA,连续用药第四天,S-217622低剂量组和高剂量组可分别将新冠病毒载量降低63%和80%,用药第六天,低剂量组病毒载量降低100%。在疗效方面,所有服用S-217622所有患者都没有发展住院程度,安慰剂组有14.3%(2/14)患者需要入院治疗。
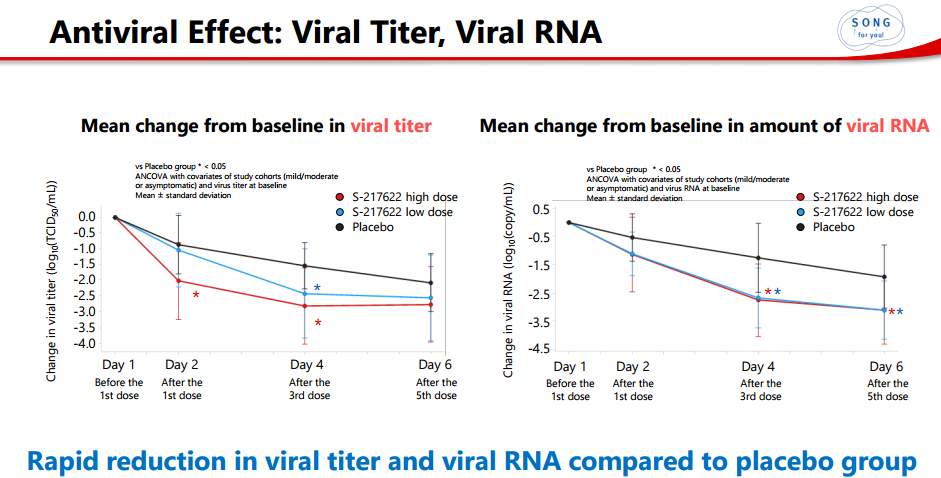
Ⅱb在试验中,428名轻中度患者(主要是奥密克戎变异株感染者)每天口服一次,连续服用S-217622五天的治疗。结果显示,与对照组新冠病毒相比,持续给药第四天滴度迅速下降;治疗组病毒滴度阳性比例小于10%,下降幅度大于Ⅱa期。
此外,盐野义宣布将加快对轻度/中度症状患者的第三期研究和对无症状/轻度症状患者的第一期研究2b/3期部分。
2月25日,盐野义向日本厚生劳动省申请批准新冠药的生产和销售。基于此前日本批准默沙东和辉瑞的新冠药上市,以及盐野义S-217622预计将成为日本第三批新冠药和日本第一批国产新冠药,因此该药受到日本政府的高度期待。目前,日本政府已与盐野义达成基本一致。如果新药获批,将购买100万人服用的剂量。同时,据悉,盐野义已完成第一批S-2176224月以后,计划实现每年1000多万人的产能供应。
或致畸,盐野义反应
据悉,怀孕的兔子使用浓度高于人体临床试验S-217622后来,结果显示,异常的致畸性。4月13日,盐野义有限公司总裁兼首席执行官Teshirogi Isao宣布,盐野义总结了他最近媒体报道的关于COVID-19口服抗病毒药物S-217622的看法。

信息显示,2022年4月4日,Shionogi收到一家日本通讯社的请求,确认他们从自己的采访中得到的关于的请求S-217622一些非临床数据信息,并提出盐野义自己的看法。信息在于。S-217622在非临床安全性研究中观察到胎儿骨骼形态异常。
46月6日,盐野义回应说,这样的观察结果出现了,并从临床角度分享了公司对这些非临床结果意义的评价。非临床研究成果于2021年12月向厚生劳动省报告(MHLW)药品和医疗器械局(PMDA) 报告,并包含在2022年2 月 25日提交的 报告中NDA 文件中。
之后,盐野义补充了相关信息和观点:
1)这项非临床研究是药物开发所需的监管安全研究之一。这些观察是在高于临床剂量的剂量下进行的,超过了预期的血液浓度和给药期。
(2)孕妇、哺乳期和可能怀孕的妇女通常被排除在临床试验之外,S-217622就是这样。
(3)及时向进行临床试验的医疗机构报告非临床研究结果,并告知临床试验者风险相关信息,包括结果,并在知情同意后参加临床试验。
(4)非临床发现的临床意义将在PMDA综合判断正在进行的批准审查,并通过该过程确定包装说明书的内容。
但是,盐野义认为这不会影响S-217622批准决定将继续和PMDA合作,推进目前正在进行的临床试验,收集更多关于安全性和有效性的信息。与此同时,盐野义正在要求适用附带条件提前审批制度,可以快速推进审查。
事实上,新冠药对孕妇构成风险,盐野义并非第一例。默沙东的新冠药Molnupiravir由于动物实验表明,该药物与胎儿损伤有关,禁止孕妇或未成年人使用。辉瑞的新冠药物Paxlovid兔子实验表明,高剂量使用Paxlovid胎儿体重减轻,但辉瑞并未限制孕妇使用。
三菱日联摩根士丹利证券分析师Naomi Kumagai认为与出生缺陷有关的可能性不是新信息,也不应影响审批。一般来说,监管机构对孕妇用药的建议不会太激进,所以禁止或衡量使用的优缺点是常规操作,更不用说其他新冠药物了。
