君实生物PD-1单抗皮下注射剂JS001 SC我国首次获批临床
3月7日,据CDE官网显示,君实生物的官网显示,PD-1单抗皮下注射剂JS001 SC我国首次获批临床(受理号:CXSL2101506),晚期鼻咽癌。
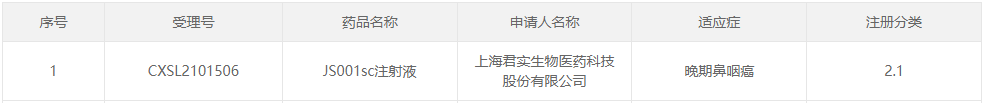
JS001sc注射液是君实生物在上市产品特瑞普利单抗注射液的基础上开发的皮下注射制剂。临床前体内疗效试验表明,JS001sc通过皮下注射给药,在动物模型中表现出显著的抑瘤作用,在 0.3mg/kg在剂量水平下,皮下注射给药JS001sc与静脉注射给药的特瑞普利单抗抑瘤相当,没有明显区别。此外,动物对动物的影响。JS001sc耐受性好。
与注射剂相比,皮下注射剂具有独特的依从性优势,给药快捷方便,可将给药时间从几个小时缩短到3到5分钟,甚至秒。随着肿瘤免疫治疗「慢病化管理」这个概念逐渐普及,这也是制药公司在红海竞争中探索的一个差异化发展方向,可能成为另一个潜在的更好的选择,除了经常去医院注射几个小时。
罗氏还在曲妥珠单抗皮下制剂的开发中进行了患者偏好测试PrefHER,240著名病人接受辅助 Herceptin Hylecta治疗,然后接受静脉曲妥珠单抗治疗,或顺序相反。结果表明,86% 患者首选皮下方案。
在中国,第一款也是目前唯一一款皮下注射PD-1/L1抑制剂是康宁杰瑞/思路迪/先声药业的恩沃利单抗,于2021年11月25日获批上市(回顾评审过程)。根据企业新闻稿,该药物可在30秒内给药,也可用于静脉注射不耐症患者。
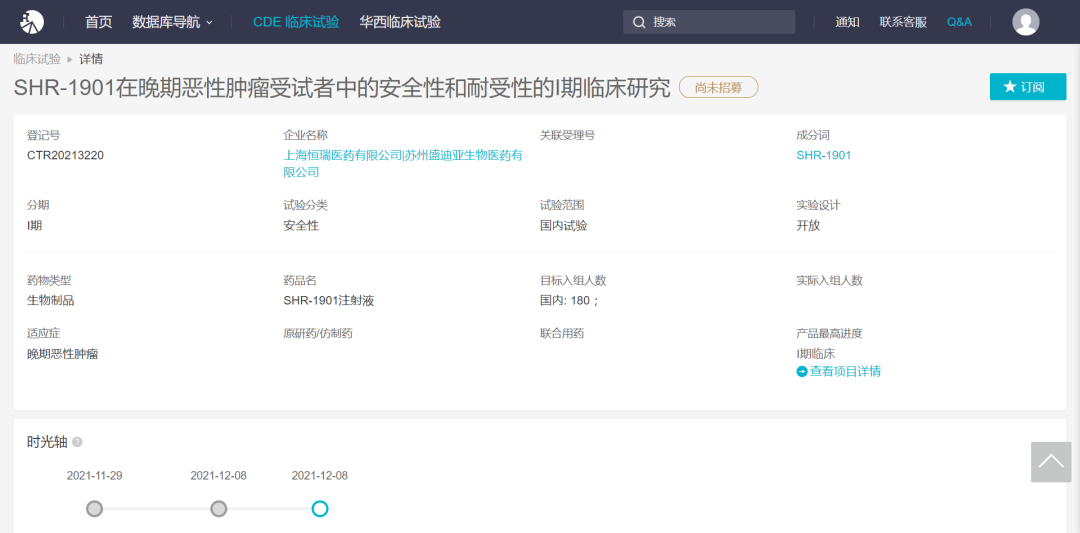
国内四大PD-1在玩家中,恒瑞医药也在去年开始注册PD-1皮下注射剂SHR-1901临床试验(点击此处查看试验细节)。
目前,辉瑞是世界上最早在同一领域起步的。2015年开始皮下注射PD-1 单抗Sasanlimab (PF-06801591) 的临床研发已进展到三个临床阶段,联合卡介苗治疗高危非肌层浸润性膀胱癌。2021年7月,辉瑞在中国注册并启动了这一临床部分(点击此跳转临床试验细节)。
在2020 ESMO会上,辉瑞更新了Sasanlimab非小细胞肺癌(NSCLC)尿路上皮癌(UC)一期首次人体临床研究数据(NCT02573259)。
截至2019年 11月1日,(NSCLC=68,UC=38)中位治疗持续时间为中位治疗113.0天。
根据疗效数据,在 mITT 非小细胞肺癌(NSCLC)人群中 20.9% 部分缓解(PR),35.8%疾病稳定(SD),客观缓解率(ORR)为 20.9%(95%CI: 11.9-32.6);在PD-L1表达 ≥1%和 ≥50%的患者ORR分别为 32.1% 和 45.5%。
在 mITT 尿路上皮癌(UC)人群中 21.1% 达到 PR(中位持续时间:183.0 天),31.6%SD(中位持续时间:118.5 天),ORR 为21.1%(95%CI: 9.6-37.3%),而在PD-L1表达 ≥1% 和 ≥ 50% 患者中 ORR 则分别为 40.0% 和 50.0%。
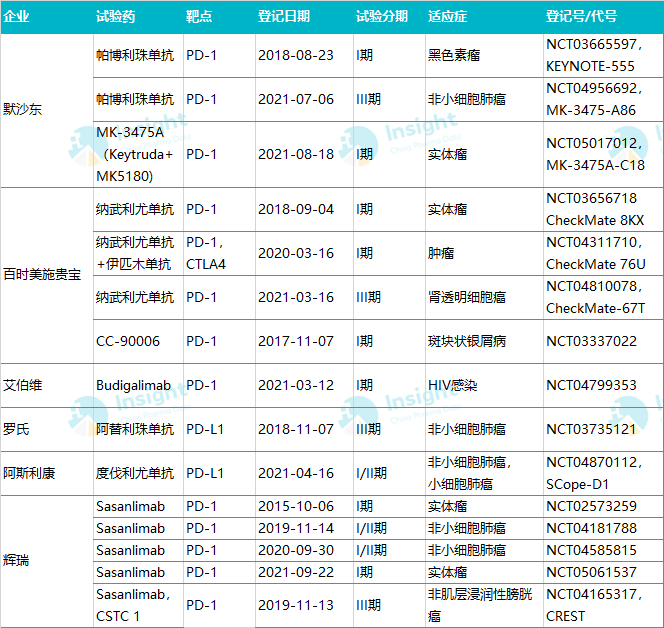
据 Insight 数据库 统计,已上市 PD-(L)1在产品中,默沙东 K 药帕博利珠单抗,百时美施贵宝 O 药纳武利尤单抗和罗氏 T 药物阿替利珠单抗均于2018年首次登记启动皮下制剂临床试验。BMS 也开发了 CTLA-4单抗伊匹木单抗(Y 药)皮下注射剂型,并于2020年启动临床,评估 O Y 皮下方案数据。目前,这3 皮下注射产品已推广到 III 期临床。I 2021年 4月也启动了 药度伐利单抗I/II 期临床,针对小细胞肺癌和非小细胞肺癌。